1、选择题 水、双氧水都是由氢、氧元素组成的重要化合物。下列表述正确的是
A.H2O2的电子式为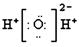
B.4℃时,纯水的pH<7,溶液呈中性
C.0℃、101kPa,水分子间距:固态>液态
D.101kPa,不同状态水的能量:固态>液态>气态
参考答案:C
本题解析:A、H2O2分子中化学键为共价键,错误;B、4℃时,水的电离程度减小,pH>7,错误;C、0℃、101kPa,固态水形成氢键,分子间距大,正确;D、101kPa,不同状态水的能量:气态>液态>固态,正确。
本题难度:一般
2、选择题 我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,下列措施不对的是(? )
A.大力发展氢能源
B.充分利用太阳能
C.使用含碳能源
D.提高能源利用率
参考答案:C
本题解析:目前全球能源还主要依靠含碳物质的燃烧。要减少二氧化碳的排放应在开发新能源、提高能源利用率等方面下工夫。
本题难度:简单
3、选择题 将pH试纸用蒸馏水湿润后,去测定某溶液的pH值,该溶液的pH值将会D
A.偏高
B.偏低
C.不变
D.上述三种情况均有可能
参考答案:D
本题解析:pH试纸用蒸馏水湿润后,所测溶液的浓度变小。如酸性溶液则PH值变大,如为碱性溶液则PH值变小,如为中性溶液则PH值不变。
本题难度:一般
4、填空题 室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=——————————————
参考答案:100 :11
本题解析:
此题是关于两种不反应的溶液混合后溶液pH值的计算,根据混合前后溶质(NaOH)量守恒,列式求解
解答:pH="10?" C(H+)=10-10mol/L? C(OH—) =10-4mol/L
pH="13?" C(H+)=10-13mol/L? C(OH—) =10-1mol/L
pH="12?" C(H+)=10-12mol/L? C(OH—) =10-2mol/L
10-4·n + 10-1·m =" (n+m)" ×10-2
n :m =" 100" :11
有关混合溶液的pH计算,题设条件可千变万化,正向、逆向思维,数字与字母交替出现,但基本题型只有两种:(1)混合后不反应,(2)混合后反应。对于溶液的稀释,可将水作为浓度为0的溶液,仍属混合后不反应一类,这一类混合溶液的pH应介于两种溶液的pH之间,因而酸、碱溶液无论加多少水稀释,其最终pH均不可能等于纯水的pH(即常温不可能为7)。混合溶液pH的计算方法也很简单,即设法求出混合溶液的C(H+),若是溶液显碱性,则必须先求出溶液的C(OH—),然后再换算为C(H+)或按OH—量守恒列式求解。
本题难度:简单
5、选择题 下面均是正丁烷与氧气反应的热化学方程式(25℃.101 kPa):
①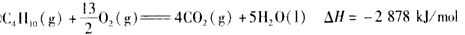
②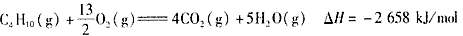
③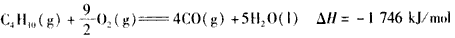
④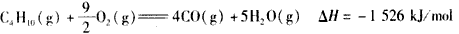
由此判断,正丁烷的燃烧热是
[? ]?
A.-2 878 kJ/mol
B.-2 658 kJ/mol
C.-1 746 kJ/mol
D.-1 526 kJ/mol
参考答案:A
本题解析:
本题难度:一般