1、选择题 利用反应:2NO(g)+2CO(g)

2CO2(g)+N2(g)△H=-746.8kJ?mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是( )
A.降低温度
B.及时将CO2和N2从反应体系中移走
C.升高温度同时充入N2
D.增大压强同时加催化剂
参考答案:A、降低温度,化学反应速率减慢,化学平衡向放热方向移动,即正反应方向,NO的转化率转化率增大,故A错误;
B、减少生成物的浓度,平衡向正反应方向移动,NO的转化率增大,但反应速率减小,故B错误;
C、升高温度,化学反应速率加快,化学平衡向吸热方向移动,即逆反应方向,NO的转化率转化率减小,同时充入N2,化学平衡向逆反应方向移动,NO的转化率转化率减小,故C错误;
D、增大压强,化学反应速率加快,化学平衡向气体体积减小的方向移动,即正反应方向,NO的转化率转化率增大,同时加催化剂,可以加快反应速率,但平衡不移动,故D正确;
故选:D.
本题解析:
本题难度:一般
2、选择题 充分说明反应P(g)+Q(g)?R(g)+S(g)在恒温下已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者共存
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
参考答案:A、该反应为体积不变的反应,反应过程中气体的总物质的量始终不变,所以压强始终不变,压强不能作为判断平衡状态的标志,故A错误;
B、任何的可逆反应中,反应物和生成物都同时存在,无法判断是否达到平衡状态,故B错误;
C、P的生成速率和S的生成速率相等,为正逆反应速率相等,达到了平衡状态,故C正确;
D、该反应方程式两边气体的物质的量不变,所以反应容器内气体的总物质的量始终不变,气体的总物质的量不能作为判断达到平衡状态的标准,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 在一定温度下,在一容积不变的密闭容器中发生可逆反应A(g)+3B(g)?2C(g),其达到平衡状态的标志是( )
A.C生成的速率与C分解的速率相等
B.单位时间生成n?mol?A,同时生成3n?mol?B
C.体系的压强不再变化
D.A、B、C的浓度之比为1:3:2
参考答案:A.当化学反应达到平衡状态时,C的正逆反应速率相等,故A选;
B.无论反应是否达到平衡状态,单位时间生成n?mol?A,同时生成3n?mol?B,所以不能作为化学平衡状态的判断依据,故B不选;
C.如果反应前后气体的化学计量数之和不相等,当(总)压强不变时,必定达到平衡状态,故C选;
D.该反应达到平衡状态时,A、B、C的浓度之比可能为1:3:2,也可能不是1:3:2,这与反应初始浓度和转化率有关,所以不能作为化学平衡状态的判断依据,故D不选.
故选AC.
本题解析:
本题难度:一般
4、填空题 (16分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
物 质
| CH4
| CO2
| CO
| H2
|
平衡浓度(mol·L-1)
| 0.5
| 0.5
| 2.0
| 2.0
|
① 此温度下,该反应的平衡常数K=________(注明单位).
② 已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
反应CO2(g)+CH4(g)  2CO(g)+2H2(g) 的 △H="_______" kJ·mol-1
2CO(g)+2H2(g) 的 △H="_______" kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应: CO2+CH4 CH3COOH, 请回答:
CH3COOH, 请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图。
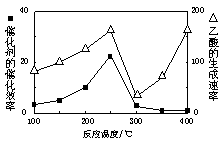
250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
② 为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为 ,每消耗3mol Cu2Al2O4时被还原的HNO3为 mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
① 若寻找吸收CO2的其他物质,下列建议合理的是___。
a. 可在碱性氧化物中寻找
b. 可在具有强氧化性的物质中寻找
c. 可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式_____。
参考答案:(16分)(1)①64 mol2·L-2 (3分,数据2分,单位1分) ②(△H1 - 2△H3 + 2△H2) (2分)
(2)① 温度在250~300℃时,催化剂的催化效率降低(2分)
②增大反应压强、增大CO2的浓度 (2分,各1分) ③ 铜(或Cu) (1分) , 2 (1分)
(3)①ac(3分,选一个对的得1分,全对3分)②CO2 + Li4SiO4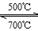 Li2CO3 + Li2SiO3 (2分)
Li2CO3 + Li2SiO3 (2分)
本题解析:(1)①根据表中物质的平衡浓度可知,该温度下的平衡常数K=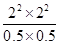 =64 mol2·L-2;
=64 mol2·L-2;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1 kJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2(g)△H2 kJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H3 kJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g) 2CO(g)+2H2(g),所以该反应的反应热△H=(△H1 - 2△H3 + 2△H2)kJ?mol-1;
2CO(g)+2H2(g),所以该反应的反应热△H=(△H1 - 2△H3 + 2△H2)kJ?mol-1;
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;
②增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,故答案为:增大反应压强、增大CO2的浓度;
③Cu2Al2O4拆成氧化物的形式:Cu2O?Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,所以被氧化的元素是铜。每消耗3mol Cu2Al2O4时生成2molNO,所以被还原的HNO3的物质的量是2mol;
(3)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;b.Li2O、Na2O、MgO均能吸收CO2,钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
故答案为:ab;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2 + Li4SiO4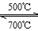 Li2CO3 + Li2SiO3。
Li2CO3 + Li2SiO3。
考点:考查盖斯定律的应用、化学平衡计算、化学平衡影响因素等
本题难度:一般
5、选择题 在平衡体系Ca(OH)2(s)?Ca2++2OH-中,能使c(Ca2+)减小,而使c(OH-)增大的是( )
A.加入少量MgCl2固体
B.加入少量Na2CO3固体
C.加入少量KCl固体
D.加入少量Ca(OH)2固体
参考答案:A.镁离子与氢氧根离子反应生成氢氧化镁沉淀,平衡右移,c(Ca2+)减小,氢氧根离子的浓度降低,故A错误;
B.钙离子与碳酸根离子结合生成碳酸钙沉淀,平衡右移,c(Ca2+)减小,c(OH-)增大,故B正确;
C.加入少量KCl固体,对平衡移动无影响,c(Ca2+)、c(OH-)不变,故C错误;
D.加入少量氢氧化钙,平衡不移动,c(Ca2+)、c(OH-)不变,故D错误,
故选:B.
本题解析:
本题难度:简单