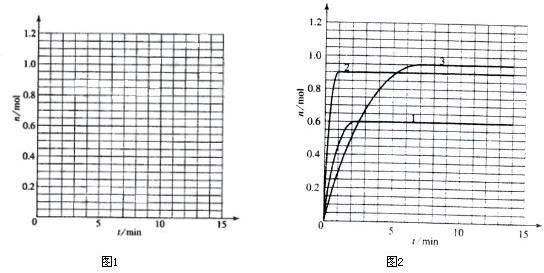
1、简答题 某温度时,在2L密闭容器中气态物质X和气态物质Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据下表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol
0
1.00
1.00
0.00
1
0.90
0.80
0.20
3
0.75
0.50
0.50
5
0.65
0.30
0.70
9
0.55
0.10
0.90
10
0.55
0.10
0.90
14
0.55
0.10
0.90
|
(2)体系中发生反应的化学方程式是______;
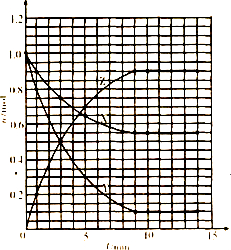
(3)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图2所示)则曲线①、②、③所对应的实验条件改变分别是:①______②______?③______.
参考答案:(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,所以X、Y、Z在相同时间内的变化量之比为1:2:2,9min后各物质的物质的量不再变化,平衡时X、Y、Z的物质的量分别为:0.55mol、0.1mol、0.9mol.
横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为:
,故答案为:

;
(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反应方程式为X+2Y

2Z,
故答案为:X+2Y

2Z;
(3)该可逆反应正反应为放热反应,且为气体体积增大的反应.
由表中数据可知,平衡时Z的物质的量为0.9mol,由图2可知曲线①平衡后,Z的物质的量为0.6,Z的物质的量减小,故平衡向逆反应移动,应是升高温度;曲线②平衡后,Z的物质的量为0.9mol,Z的物质的量未变,应是使用催化剂;曲线③平衡后,Z的物质的量为0.95mol,Z的物质的量增大,应是增大压强,
故答案为:升高温度;加入催化剂;增大压强.
本题解析:
本题难度:一般
2、选择题 已知N2+3H2?2NH3△H<O,反应速率为V1;2HI?H2+I2△H>O,反应速率为V2.对于上述两个可逆反应,当升高温度时,V1和V2的变化情况为( )
A.同时增大
B.同时减小
C.V1增大,V2减小
D.V1减小,V2增大
参考答案:无论化学反应是放热反应还是吸热反应,只要升高温度,化学反应速率就一定增大,但升高温度,平衡向吸热反应方向移动,故选A.
本题解析:
本题难度:简单
3、选择题 下列说法正确的是 ( )
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.③④⑥
B.①②⑤
C.③④⑤⑥
D.②③④
参考答案:A
本题解析:活化分子间的碰撞不一定能发生化学反应,①错误;只有活化分子才能发生有效碰撞,②错误;使用催化剂能提高反应速率,原因是催化剂可以降低反应的活化能,使有效碰撞频率增大,⑤错误,其余选项都是正确的,答案选A。
点评:该题是中等难度试题的考查,侧重考查学生对活化分子、有效碰撞等有关概念的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
4、选择题 下图表示2A(g)+B(g) 2C(g)(正反应放热)。这个可逆反应的正确图像为
2C(g)(正反应放热)。这个可逆反应的正确图像为
[? ]
A.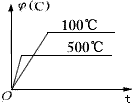
B.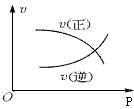
C.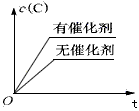 ?
?
D.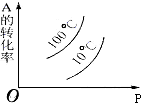 ?
?
参考答案:A
本题解析:
本题难度:一般
5、选择题 可逆反应2A+B?2C(g)△H<0,随温度变化气体平均相对分子质量如图所示,则下列叙述正确的是( )
A.A和B可能都是固体
B.A和B一定都是气体
C.A和B可能都是液体
D.若B为固体,则A一定是气体
