1、计算题 (共7分)今有盐酸、硫酸混合液100 mL,向其中加入足量氯化钡溶液,反应完
全后,过滤,将沉淀洗涤、烘干,称得沉淀的质量为9.32g。向滤液中加入500 mL 0.2
mol/L的氢氧化钠溶液呈中性。求混合液中盐酸、硫酸的物质的量浓度各为:
(1)硫酸的物质的量浓度为____________
(2)盐酸的物质的量浓度为____________
参考答案:H2SO4:0.4 mol/L (3分) HCl:0.2 mol/L (4分)
本题解析:考查物质的量的有关计算。
(1)生成沉淀的方程式是H2SO4+BaCl2=2HCl+BaSO4↓
硫酸钡的质量是9.32g
则硫酸钡的物质的量是9.32g÷233g/mol=0.04mol
所以硫酸的物质的量也是0.04mol
根据c=n/V可知
硫酸的浓度是0.04mol÷0.1L=0.4mol/L
(2)消耗氢氧化钠的物质的量是0.5L× 0.2 mol/L=0.1mol
硫酸中氢离子的物质的量是0.08mol
所以盐酸的物质的量是0.1mol-0.08mol=0.02mol
因此盐酸的浓度是0.02mol÷0.1L=0.2mol/L
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是?
A.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1 NA个胶粒
B.1molCu与足量的硫固体反应转移的电子数为NA
C.标准状况下,2.24 L三氧化硫所含分子数为0.1NA
D.只有在标准状况下,NA个氧气分子所占的体积才是22.4 L
参考答案:B
本题解析:A选项错误,胶粒是小分子的集合体,所以在氢氧化铝胶体中胶粒数小于0.1NA.
B正确,可变价金属与S反应生成低价金属硫化物,2Cu+S=Cu2S.转移电子数为NA,应该选B.
C选项错误,标况下的三氧化硫是固体.
D选项错误,在非标准状况下,1mol氧气也有可能占22.4L的体积.
本题难度:一般
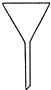
3、选择题 实验室配置0.1mol?L-1Na2CO3溶液100mL,需使用的玻璃仪器是( )
A.
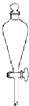
B.
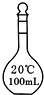
C.
D.
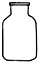
参考答案:B
本题解析:
本题难度:一般
4、选择题 用Na2CO3固体配制一定物质的量浓度的Na2CO3溶液时,不需要使用的玻璃仪器是
A.容量瓶
B.玻璃棒
C.漏斗
D.烧杯