1、填空题 实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 + 16HCl(浓)=" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O
(1)在该反应中,氧化剂是?,还原剂是?。
(2)当有0.10mol电子发生转移时,生成氯气的体积为?(标准状况),发生反应的KMnO4的质量为?。
参考答案:
本题解析:略
本题难度:简单
2、选择题 如图所示,大试管里充满某混合气体,置于光亮处,将滴管里的水挤入大试管后,烧杯中的水会进入大试管,大试管里的气体可能是
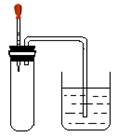
①N2、H2;②CO、O2; ③NO2、O2;④CH4、Cl2
A.①或③
B.②或④
C.①或③或④
D.③或④
参考答案:D
本题解析:烧杯中的水会进入大试管,说明大试管中气体体积减少,压强减小造成的;①N2和H2不反应;②CO和O2不反应;③NO2、O2和水能反应,气体体积减小;④CH4和Cl2在光照条件下,发生取代反应,生成液体氯代烃,气体体积减少;满足题意的是③或④,选D。
本题难度:一般
3、实验题 某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
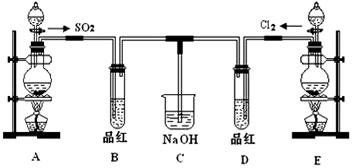
(1)C装置的作用:______________________________。
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B_________________________, D________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B_________________________, D________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色。请你分析产生该现象的原因_____________________________(用化学方程式表示)。
参考答案:(1)尾气处理,吸收SO2和Cl2防止污染环境(2分)
(2)HCl(2分)
(3)①品红褪色? (2分);?品红褪色。 ?(2分)
本题解析:(1)C装置的作用是除去B中剩余的SO2和D项剩余的Cl2,故C的作用是尾气处理,吸收SO2和Cl2防止污染环境。
(2)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O ?HCl作为还原剂,失去电子,发生氧化反应
MnCl2+Cl2↑+2H2O ?HCl作为还原剂,失去电子,发生氧化反应
(3)SO2和 Cl2都能使品红褪色 ,加热后B中褪色的品红溶液又恢复红色而D项无明显现象,主要是因为SO2与水作用生成的亚硫酸的漂白性具有不稳定性,加热后溶液又恢复到原来的颜色,而D项中实质是生成的HClO使品红溶液褪色,加热后溶液不褪色。
(4)Cl2和SO2在水的作用下发生如下反应:Cl2+SO2+2H2O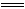
 2HCl+H2SO4 HCl和H2SO4都无漂白性。(2分)2和氯水的漂白性
2HCl+H2SO4 HCl和H2SO4都无漂白性。(2分)2和氯水的漂白性
点评:SO2和氯水的漂白原理是高中化学的一个难点,本题侧重考查学生的实验探究能力和分析问题的能力,考生平时要注意学会多观察,多动脑。
本题难度:一般
4、选择题 下列现象或事实可用同一原理解释的是( )
A.氯水和SO2使品红溶液褪色
B.乙炔和乙烯使溴的四氯化碳溶液褪色
C.浓硝酸和浓盐酸长期暴露在有光照的空气中浓度降低
D.过氧化钠和水玻璃长期暴露在空气中最后均变质失效
参考答案:A、氯水中含有次氯酸,具有强氧化性,使品红褪色,不能复原,SO2与品红发生化合使品红褪色,加热能复原,二者褪色原理不同,故A错误;
B、乙烯和乙炔都含有不饱和键,与溴发生加成反应而使溴水褪色,原理相同,故B正确;
C、硝酸的不稳定,在光照条件下能分解,属于化学变化,盐酸易挥发,属于物理变化,二者浓度变小原理不同,故C错误;
D、过氧化钠与空气中二氧化碳发生氧化还原反应,硅酸比碳酸弱,水玻璃长期暴露在空气中最后生成硅酸,二者原理不同,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 已知NH3和HCl都是能用来作喷泉实验的气体,若在同温同压下用等体积的烧瓶各收集满NH3和HCl气体,喷泉实验后(假设溶液充满整个烧瓶)两个烧瓶中溶液的关系是
A.溶质的物质的量浓度相同,溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
参考答案:A
本题解析:因NH3和HCl在同温同压下体积相同,则二者物质的量相同,又溶液充满整个烧瓶,即溶液的体积相同,所以二者物质的量浓度相同;又二者摩尔质量不同,因此质量分数不同。
本题难度:简单