1、选择题 下列关于氯水的说法正确的是
A.新制的氯水只含有氯气分子和水分子
B.新制氯水可使紫色石蕊试液先变红后褪色
C.光照氯水有气泡逸出,该气体主要是氯气
D.新制氯水久置后漂白性增强
参考答案:B
本题解析:略
本题难度:简单
2、选择题 向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是
[? ]
①HCO3- ②SO32- ③OH- ④Fe2+
A.①②
B.③④
C.①②③
D.①②③④
参考答案:D
本题解析:
本题难度:一般
3、填空题 某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了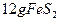 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成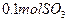 ,可放出
,可放出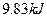 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_?____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_?____________________________。
参考答案:(1)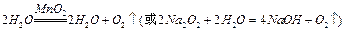 (2分)
(2分)
(2)氧气;1.1mol(4分)?(3)催化剂中毒(1分)
(4)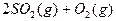
? ;
; ?;(2分)
?;(2分)
在常压下400℃~500℃时, 的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。?(3分)
的转化率已相当高,加压对SO2的转化率提高不多,且加压对设备的要求高,增大投资和能量消耗。?(3分)
本题解析:(1)由装置A为固+液(不加热)型制取气体的装置,结合(2)中给出的提示:黄铁矿粉末在高温条件下和A装置制出的氧气充分反应,可联想到双氧水在二氧化锰作用下制氧气。(2)FeS2是还原剂,O2是氧化剂;
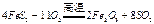 ?~ 44 e-
?~ 44 e-
4? 44
0.1mol? 1.1mol
△
本题难度:一般
4、填空题 (12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为?。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为?。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为?。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为?。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于?。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为? (填序号)。
参考答案:(1)[Ar]3d104s24p5 ?(2) BrI> ICl> Cl2?(3)RbCl?(4)直线形?(5)HF分子间形成氢键?(6)①②③? (每空2分,共12分)
本题解析:(1)溴为四层电子,最外层为七个电子:[Ar]3d104s24p5
(2)分子晶体的沸点一般与分子量大小相关: BrI> ICl> Cl2
(3)随着卤离子的半径增大,所形成卤化物的晶格能越低,故Rb与Cl之间的晶格能大于与I之间的,故A为RbCl
(4)可看作AB2型微粒处理,孤对电子有(7+1-2×1)÷2=5对,两个键对,故价层电子对构型为三角双锥形,微粒构型为直线型
(5)HF分子间形成氢键,易形成聚合分子
(6)含氧酸分子结构中含非羟基氧原子越多,该含氧酸的酸性越强,而HClO4、HIO4的非羟基氧原子为3个,H5IO6为1个;而HClO4、HIO4的酸性相比,氯的非金属性强,其酸性相对较强,故酸性由强到弱的顺序为①②③
本题难度:一般
5、计算题 工业上常用漂白粉跟酸反应放出的氯气的质量分数x%来表示漂白粉的优劣。漂白粉与酸反应为:Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2H2O+2Cl2↑,又知I2与Na2S2O3溶液反应为I2+2Na2S2O3=Na2S4O6+2NaI。
现为了测定一瓶漂白粉的x%,进行了如下实验。称取漂白粉样品2.00g,加水研磨后,转入250mL容量瓶内,用水稀释至刻度。摇匀后,取出25.0mL,加入过量的KI溶液和过量的稀H2SO4,静置。待漂白粉放出的氯气与KI完全反应后,用0.100mol/L Na2S2O3溶液20.0mL。试由上述数据计算该漂白粉的x%。
参考答案:
35.5%
本题解析:
由Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2H2O+2Cl2↑、Cl2+2KI=2KCl+I2
及I2+2Na2S2O3=Na2S4O6+2NaI可得
Cl2~2Na2S2O3
1? 2
n(Cl2) 0.100mol/L×0.02L×10
则n(Cl2)= 1×10-2 mol,所以m(Cl2)= 1×10-2 mol×71 g·mol-1="0.71" g
x%=0.71g/2.00g=35.5%
本题难度:简单