1、计算题 生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO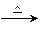 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
参考答案:(1)0.075mol
(2)5.56%
本题解析:(1)由题目所给方程式可判断气体中甲烷的物质的量为0.075mol。
(2)通入石灰水中的二氧化碳总物质的量为0.085mol,所以原混合气体中二氧化碳的物质的量为0.01mol。气体的总物质的量为0.09mol,则氮气的体积分数为5.56%。
本题难度:一般
2、选择题 在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%.在用CH3C═CH合成CH2═C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要的其他反应物有( )
A.CO2和H2O
B.CO和CH3OH
C.CH3OH和H2
D.H2和CO2
参考答案:由于在“绿色化学”工艺中,原子利用率为100%,故生成的产品CH2═C(CH3)COOCH3与原料之间元素种类和原子数目都完全相同,即原子守恒.将生成物中各原子个数减去反应物中各原子个数得到一些原子,无污染的反应途径和工艺是在始态实现污染预防,而非终端治理的科学手段.由于在通过化学转化获取新物质的过程中已充分利用了各种原料,因而生产过程和末端的差值为C2H4O2,对照选项,反应物中原子数之和为C2H4O2的只有B.
用CH3C═CH(丙炔)合成CH2═C(CH3)COOCH3(2-甲基丙烯酸甲酯),要把一个C3H4分子变成一个C5H8O2分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中另外的物质中C、H、O的原子个数比为1:2:1.
A、CO2和H2O,两种物质分子里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故A错误;
B、CO和CH3OH,两种物质如果按照分子个数比1:1组合,则C、H、O的原子个数比为1:2:1,故B正确;
C、CH3OH和H2,两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故C错误;
D、H2和CO2,,两种物质分子里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故D错误;
故选B.
本题解析:
本题难度:一般
3、填空题 (16分)氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
⑴以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度。能包含这一过程的总反应方程式为?
⑵现代氯碱工业多采用隔膜法进行电解,即用隔膜将电解槽分隔成阳极区和阴极区,则从阴极区排出的是??,电解时用盐酸控制阳极区的PH在2~3,用化学平衡移动原理解释盐酸的作用:?
?
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
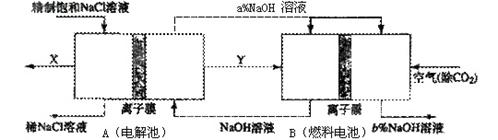 ?①分析比较图中氢氧化鈉质量分数大小:a%?(填“>”、“<”或“=”) b%,?理由是
?①分析比较图中氢氧化鈉质量分数大小:a%?(填“>”、“<”或“=”) b%,?理由是
?
②这样设计的主要节(电))能之处在于?(至少写一处)
⑷科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱厂进行就近联合。请你判断该方案是否可行??(填可行或不可行),理由是?
参考答案:(1)NaCl+H2O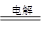 NaClO+H2↑
NaClO+H2↑
(2)H2和NaOH;? Cl2与水反应:Cl2+ H2O= HClO+HCl,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出
(3)①<;在B中右侧为燃料电池正极,氧气被还原产生OH-,同时Na+通过离子膜移到该侧,所以NaOH溶液浓度增大
②燃料电池可以补充电解池消耗的电能(或燃料电池提高了产出碱液的浓度,降低能耗等其他合理答案均可)
(4)可行;将发电厂产生的废气(SO2)与氯碱厂产生的Cl2或NaOH反应,既减少了SO2的排放,又可产生多种化学原料,同时就近联合还能减少电力输送中的损耗(其他合理答案均可)
本题解析:(1)生成物是次氯酸钠和氢气,所以总反应式为NaCl+H2O NaClO+H2↑。
NaClO+H2↑。
(2)惰性电极电极氯化钠溶液,阴极是氢离子放电,从而破坏阴极周围水的电离平衡,从而阴极溶液显碱性,即阴极生成物是氢气和氢氧化钠。阳极是氯离子放电生成氯气,由于Cl2与水反应:Cl2+ H2O= HClO+HCl,增大HCl的浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。
(2)①根据装置图可知,B中右侧通入空气,所以是正极,氧气被还原产生OH-,同时Na+通过离子膜移到该侧,所以NaOH溶液浓度增大。
②这样设计可以通过燃料电池来补充电解池消耗的电能。
(4)由于发电厂产生的废气(SO2)与氯碱厂产生的Cl2或NaOH反应,既减少了SO2的排放,又可产生多种化学原料,同时就近联合还能减少电力输送中的损耗,所以是可以的。
本题难度:一般
4、选择题 下列工业生产的有关说法正确的是
A.石油的分馏和干馏都是复杂的物理变化和化学变化
B.工业上生产酒精,可以用发酵法和乙烯水化法
C.工业生产聚氯乙烯的反应原理是利用缩聚反应
D.石油裂解气能使溴水褪色,但不能使酸性高锰酸钾褪色
参考答案:B
本题解析:略
本题难度:一般
5、填空题 (6分)利用天然气合成氨的工艺流程示意如下:
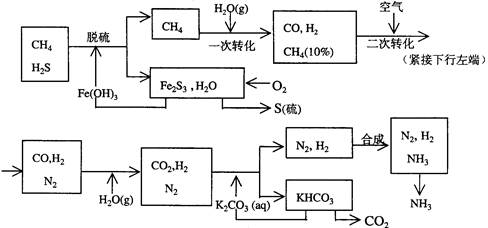
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是________________________________
(2)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是_____
(a)相似相溶原理?(b)勒沙特列原理?(c)酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于______________(写出CO2的一种重要用途)。
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
参考答案:(6分)(1)3H2S + 2Fe(OH)3 = Fe2S3 + 6H2O? (2分)
(2)b?(1分)? (3)生产纯碱?(1分)
(4)(2分)
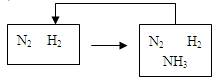
本题解析:略
本题难度:一般