1、填空题 C、N、Si、Fe等元素及其化合物有重要的应用。
(1)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(2)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________(填写序号)。

(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是____________(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
(4)一定条件下,C元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有___________个C原子。
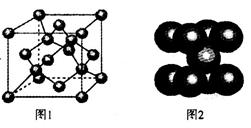
(5)图2为金属铁某种晶体的晶胞结构,已知该晶体的密度为a g/cm3为阿伏加德罗常数的值,则该晶胞的体积为_________cm3.
参考答案:(8分)(1)Fe或铁(2分)?(2)d(1分)?(3)N>C>Si(1分)? 30(1分)
(4)8(1分)?(5)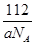 (2分)
(2分)
本题解析:(1)根据构造原理可知,C、N、Si、Fe的核外电子排布分别是1s22s22p2、1s22s22p3、1s22s22p63s23p2、1s22s22p63s23p63d54s2,所以未成对电子数最多的元素是铁。
(2)苯环是平面型结构,则甲苯中碳原子是sp2和sp3杂化;甲烷是烷烃,碳原子是sp3杂化;碳碳双键是平面型结构,则丙烯分子中碳原子是sp2和sp3杂化;碳碳三键是直线型结构,所以1-丁炔分子中碳原子是sp和sp3杂化,答案选d。
(3)非金属性越强,电负性越大,则C、Si、N原子电负性由大到小的顺序是N>C>Si;Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,所以每个Si原子形成2个单键和1个双键,则双键个数是60÷2=30,又因为双键都是由1个δ键和1个π键构成的,因此Si60分子中π键的数目为30。
(4)根据晶胞的结构并依据均摊法可知,晶胞中含有的碳原子数=8×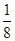 +6×
+6×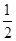 +4=8个。
+4=8个。
(5)铁是体心立方堆积,晶胞中含有的铁原子数=8×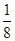 +1=2个,则
+1=2个,则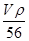 ×NA=2,解得V=
×NA=2,解得V=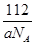 。
。
本题难度:一般
2、简答题 下列叙述正确的是( )
A.离子化合物中不可能含有共价键
B.共价化合物中不可能含有离子键
C.非极性分子中一定含有非极性键
D.由极性键形成的分子一定是极性分子
参考答案:A、离子化合物中可能含有共价键,如NaOH等,故A错误;
B、共价化合物中一定不含离子键,故B正确;
C、非极性分子中可能不含非极性键,如CCl4等,故C错误;
D、由极性键形成的分子可能是非极性分子,如CO2、CCl4等,故D错误;
故选B.
本题解析:
本题难度:一般
3、选择题 已知信息:[Cu(NH3)4]SO4的电离方程式为:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。 具有6个配体的Co3+的配合物CoClm·n NH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m、n的值分别是
A.m=1,n=5
B.m=3,n=4
C.m=5,n=1
D.m=3,n=3
参考答案:B
本题解析:1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,这说明分子中有1个氯离子不是配体。又因为钴元素是+3价的,所以m=3。由于配位数是6,则n=4,答案选B。
点评:该题是中等难度的试题,主要是考查学生对配位健含义以及形成特点的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑思维能力和创新思维能力。
本题难度:简单
4、选择题 下列化学用语正确的是( )
A.CO2的电子式: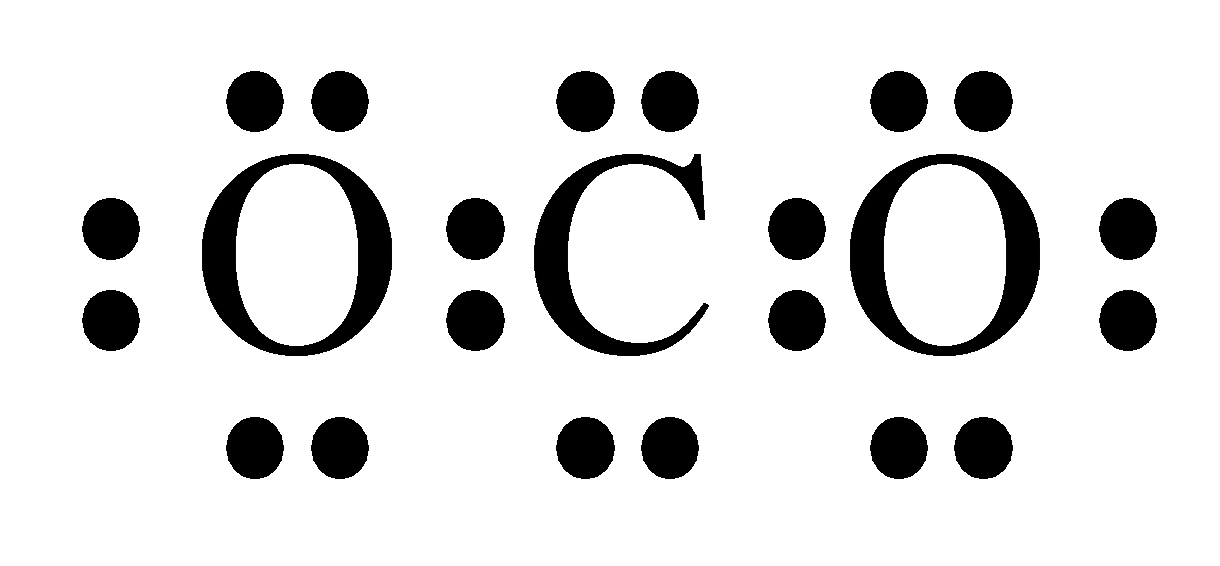
B.乙醛的结构简式:CH3COH
C.甲烷分子的比例模型
D.6个中子的碳原子的核素符号12C
参考答案:A.CO2的电子式为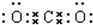 ,故A错误;
,故A错误;
B.乙醛的结构简式为CH3CHO,故B错误;
C.甲烷分子的比例模型为 ,故C正确;
,故C正确;
D.6个中子的碳原子的核素符号126C,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 键能是破坏1mol化学键吸收的热量或者生成1mol化学键放出的热量,解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是①HF、HCl、HBr、HI的热稳定性依次减弱②NH3易液化③F2、C12、Br2、I2的熔、沸点逐渐升高?④H2S的熔沸点小于H2O的熔沸点?⑤NaF、NaCl、NaBr、NaI的熔点依次减低( )
A.②③④
B.③④⑤
C.②③④⑤
D.全部
参考答案:A
本题解析:
本题难度:一般