1、选择题 X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17.则下列有关叙述正确的是( )
A.Y、Z和W三种元素可能位于同一周期
B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高
C.Y和W所形成的含氧酸均为强酸
D.X、Y、Z和W可以组成原子的物质的量之比为5:1:4:1的离子化合物
参考答案:原子核内没有中子的原子为H,如果Y、Z和W为同周期相邻,则最外层电子数可分别认为是n-1、n、n+1,之和为3n,是3的倍数,现在17不是3的倍数,所以不是同周期相邻,
一般是两个同周期,两个同主族,所以最外层电子分别为n-1、n、n,之和为3n-1,
或是n、n、n+1,之和为3n+1,也就是就这个和与3的倍数差1,这个倍数就是其中两种元素的主族数.
该题中17=18-1,18为6的倍数,所以有两种元素位于第6主族,短周期中只有O和S,
O的原子序数为8,S的原子序数为16,则另一种原子的原子序数为31-8-16=7,为N元素,
所以X为H元素,Y、Z和W应分别是N、O、S元素,则
A.Y、Z和W三种元素的原子最外层电子数之和为17,不是3的倍数,所以不是同周期相邻,故A错误;
B.因H2O或H2O2的熔沸点均比H2S高,故B错误;
C.亚硝酸、亚硫酸虽然属于含氧酸,但都是弱酸,故C错误;
D.离子化合物NH4HSO4中氢、氮、氧、硫的原子个数比为5:1:4:1,故D正确,
故选D.
本题解析:
本题难度:简单
2、选择题 下列说法中错误的是
A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C.非金属单质只能形成分子晶体
D.短周期元素离子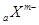 和
和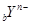 具有相同的电子层结构,若
具有相同的电子层结构,若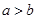 ,则
,则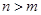
参考答案:C
本题解析:A正确,干冰为分子晶体,熔化时要克服分子间的作用力,而二氧化硅为原子晶体,熔化时要克服共价键;B正确,C2H5OH分子间存在氢键,而C2H5Br不存在氢键,氢键的存在能影响物质的熔沸点;C错,如金刚石、晶体硅都是非金属单质,但属于原子晶体;D正确,具有相同电子层结构的离子,核外电子总数相同,即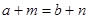 ,若
,若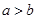 ,则
,则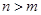
本题难度:一般
3、选择题 下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
[? ]
A. NH4Cl NH3↑ +HCl↑
NH3↑ +HCl↑
B. NH3+CO2+H2O=NH4HCO3
C. 2NaOH+Cl2=NaCl+NaClO+H2O
D. 2Na2O2+2CO2=2Na2CO3+O2
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列分子中划横线的原子采取的杂化方式为 sp杂化的是( )
A.CH4
B.C2H4
C.C2H2
D.NH3
参考答案:C
本题解析:甲烷是正四面体型结构,碳原子是sp3杂化。乙烯是平面型结构,碳原子是sp2杂化。乙炔是直线型结构,碳原子是sp杂化。氨气是三角锥形结构,氮原子含有1对孤对电子,氮原子是sp3杂化,答案选C。
点评:该题是常识性知识的考查,侧重对学生基础知识的巩固,意在培养学生分析问题、解决问题的能力。该题需要在掌握价层电子对互斥理论的基础上,熟练记住常见分子的空间构型特点,有利于培养学生的应试能力,提高学生的学习效率。
本题难度:一般
5、选择题 J、L、M、R是原子序数依次增大的短周期主族元素,J、M在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;L是地壳中含量排第二位的元素.下列说法正确的是( )
A.J在周期表的位置是第二周期ⅣA族
B.M元素的氢化物在同主族元素氢化物中最稳定
C.R元素的最高价氧化物对应的水化物的酸性最强
D.L的氧化物易溶于水
