1、选择题 在短周期元素中,若某元素原子的最外层原子数与其电子层数相等,则符合条件的元素种数为(? )
A.1种
B.2种
C.3种
D.4种
参考答案:C
本题解析:解题时要注意元素为短周期元素,因此该元素只可能为H、Be、Al。
本题难度:简单
2、选择题 下列有关物质性质的比较中,正确的是(?)
①沸点:H2O>HCl>HF? ?②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4 ?④离子半径:O2->F->Na+
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:氟化氢分子间存在氢键,沸点高于氯化氢的,①不正确,沸点:H2O >HF>HCl;非金属性越强,最高价氧化物的水化物的酸性越强,③不正确,酸性:H3PO4<H2SO4<HClO4;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,④正确,答案选B。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:简单
3、选择题 下列排列顺序正确的是:
①热稳定性:H2O>HF>H2S?②原子半径:Na>Mg>O
③酸性:H3PO4>H2AsO4>H2SO4 ?④离子半径:O2->F->Mg2+
A.①③
B.②④
C.①④
D.②③
参考答案:B
本题解析:略
本题难度:简单
4、填空题 合金是建筑航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置是?。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为??。
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为?。焊接过程中使用的保护气为?(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为?。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为?。
(3)航母螺旋浆主要用铜合金制造。
①80.0gCu-Al合金用酸完全溶解后,加入过量氨水,过滤得到白色沉淀39.0,则合金中Cu的质量分数为?。
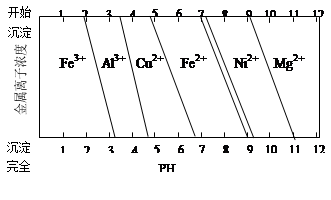
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合如图信息推断该合金中除铜外一定含有?。
参考答案:(14分)
(1)① 第三周期第Ⅲ族,CO2
② Al2O3+2NaOH=2NaAlO2+H2O,Ar(其它合理答案均可得分)
(2)① 吸氧腐蚀 ② CaCO3或CaO
(3)① 83.1% ② Al、Ni
本题解析:
(1)①铝土矿中的Al2O3与NaOH反应生成NaAlO2,通入CO2可生成氢氧化铝。
②Al2O3与NaOH反应生成NaAlO2和H2O;为防止合金被氧化,需要加惰性气体,如Ar等。
(2)①海水为中性,舰体中的钢发生吸氧腐蚀。
②CaO能与生铁中的SiO2反应生成CaSiO3和CO2,从而降低生铁中硅的含量。
(3)①白色沉淀为Al(OH)3,可得Cu的质量分数为:(80.0g-27 g?mol?1×39.0g/78 g?mol?1)/80.0g×100%= 83.1%
②根据题目所给图可以看出,Al3+在pH=3.4时开始转化为沉淀,说明合金中含Al,在pH为7.0、8.0时过滤沉淀,说明pH7.0到8.0范围内生成沉淀,根据图可以看出Ni2+在这个范围内转化为沉淀,说明合金中含Ni。
【考点定位】本题考查元素周期表、金属的腐蚀、化学方程式的书写、质量分数的计算、金属的冶炼和物质成分的判断。
本题难度:一般
5、填空题 (10分)下表是部分短周期元素的原子半径及主要化合价:
元素代号
| W
| R
| X
| Y
| Z
| Q
|
原子半径/nm
| 0.037
| 0.186
| 0.074
| 0.075
| 0.077
| 0.110
|
主要化合价
| +1
| +1
| -2
| -3,+5
| +2、+4
| -3、+5
|
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位置是?。
(2)Y的氢化物比Q的氢化物沸点高的原因是?。
(3)X或与R按1∶1的原子个数比形成化合物甲,甲中存在的化学键有?;X可与W组成含18e-的化合物乙,则乙的电子式为?;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键。1 mol
丙气体可与2 mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式?。
参考答案:(1)第三周期IA族?(2)NH3的分子间存在氢键

 (3)离子,非极性键(或离子键,共价键);H∶O∶O∶H;O=C=C=C=0
(3)离子,非极性键(或离子键,共价键);H∶O∶O∶H;O=C=C=C=0
本题解析:略
本题难度:简单