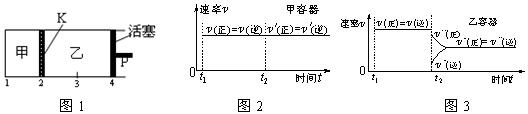
1、选择题 一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是(?)
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是(?)
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
参考答案:D
本题解析:略
本题难度:简单
2、选择题 根据下列有关图象,说法正确的是
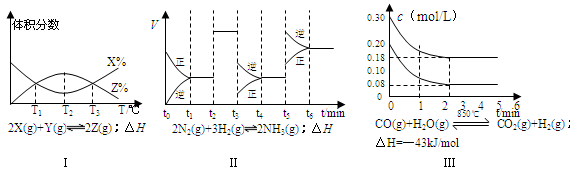
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
参考答案:D
本题解析:A:T1时刻,反应达到平衡,平衡后继续升温,反应物X的量增大,平衡左移,则正反应的△H<0? B:由图知反应在t3、t6处均向逆向移动,故反应在t6时,NH3体积分数最小;C:t3时正逆反应速率均降低,且平衡向逆向移动,可知降低了压强;D:从图可知反应中各物质均有0.12 mol的物质的量的变化,反应放出5.16kJ的热量
本题难度:一般
3、选择题 下列事实不能用勒沙特列原理解释的是(? )
A.氨水应密闭保存,放置低温处
B.在FeC12溶液中加入铁粉防止氧化变质
C.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
D.实验室可用排饱和食盐水的方法收集氯气
参考答案:B
本题解析:勒沙特列原理为平衡移动原理,在使用勒沙特列原理时,反应必须是可逆反应存在平衡移动,且移动方向符合勒沙特列原理。A、氨水中存在平衡:NH3 + H2O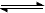 NH3·H2O
NH3·H2O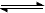 NH4+ + OH-,温度升高,一水合氨易分解,平衡左移,应密闭保存,放置低温处,能用勒沙特列原理解释,错误;B、在FeC12溶液中加入铁粉防止氧化变质,反应为:2Fe3++Fe═3Fe2+,不是可逆反应,不能利用勒沙特列原理解释,正确;C、醋酸溶液中存在:CH3COOH
NH4+ + OH-,温度升高,一水合氨易分解,平衡左移,应密闭保存,放置低温处,能用勒沙特列原理解释,错误;B、在FeC12溶液中加入铁粉防止氧化变质,反应为:2Fe3++Fe═3Fe2+,不是可逆反应,不能利用勒沙特列原理解释,正确;C、醋酸溶液中存在:CH3COOH CH3COO—+H+,加水稀释,促进电离,常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5,能用勒沙特列原理解释,错误;D、氯水中存在平衡:Cl2+H2O
CH3COO—+H+,加水稀释,促进电离,常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5,能用勒沙特列原理解释,错误;D、氯水中存在平衡:Cl2+H2O HCl +HClO,饱和食盐水中含有大量氯离子,抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒沙特列原理解释,错误。
HCl +HClO,饱和食盐水中含有大量氯离子,抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,能用勒沙特列原理解释,错误。
本题难度:一般
4、填空题 (9分)在一有有色气体参加的可逆反应中,体系的颜色变化往往用来说明平衡的建立或平衡的移动,而对这种颜色变化的观察又受到观察角度及操作过程的不同而有所变化。如图所示,在一定温度、压强下,在透明的玻璃圆筒中装入NO2、N2O4的混合气体100ml,并使可逆反应2NO2 N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
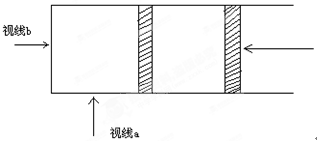
⑴将混合气体突然压缩至50mL则通过视线a方向观察到的平衡体系的颜色变化是____________。而由视线b方向观察到的平衡体系的颜色变化是________________。说明造成从a、b 不同方向观察的颜色变化趋势不同的原因是_________________________________________________________。
⑵将混合气体缓缓压缩至50mL,则由视线a方向观察到的颜色变化为________________________-。
⑶上述气体采用上述两种不同的压缩方法,都于相同温度和50mL体积的状态下达到平衡,则此时平衡体系的平均分子量M1和M2的关系为_______________-。气体颜色___________________(填“相同”或“不同”)
⑷在相同温度、压强下,若容器起初只装入N2O4,达平衡后,重复上述实验,现象是否相同____________。
⑸在NO2生成N2O4的可逆反应里,逆反应是??(填吸热、放热)反应:2NO2 (g)? N2O4(g) ?,压缩时该平衡体系向环境??(吸收、放出)热量。
参考答案:(1)先变深后变浅?渐渐变浅?在a方向压缩有明显浓度改变、而b方向压缩时,有色分子浓度是一定的(2分)
(2)渐渐变深?
(3)M1=M2(2分)?相同
(4)相同
(5)吸热?放出
本题解析:
(1)先发生物理变化,颜色变深,再发生化学变化,平衡向气体体积减小的方向移动,颜色变浅:a方向观察先变深后变浅?b方向观察渐渐变浅?在a方向压缩有明显浓度改变、而b方向压缩时,有色分子浓度是一定的(2分)
(2)渐渐变深?
(3)最终两平稀是等效平衡:M1=M2?相同
(4)无论是正向建立平衡还是逆向建立平衡,条件相同最终两平稀是等效平衡:相同
(5)吸热?放出
本题难度:一般
5、填空题 (10分)在某2 L的密闭容器中加入0.1 mol碘单质和足量钨(W),在943 K时,发生反应W(s)+I2(g) WI2(g),当I2的转化率为20%时,达化学平衡状态。
WI2(g),当I2的转化率为20%时,达化学平衡状态。
(1)反应从开始至平衡状态过程中用时20 s,其平均反应速率v(WI2)为________。
(2)943 K时,该反应的平衡常数K=________。
(3)若起始时,加入的碘为0.2 mol(其他条件不变)达平衡时容器中气体的体积比
V(I2)∶V(WI2)=________。
(4)在上述(1)平衡状态下,同时增加I2(g)和WI2(g)各0.02 mol(其他条件不变),化学平衡向________(填“正反应”或“逆反应”)方向移动,判断的依据是______________________。
参考答案:(1)5×10-4mol·L-1·s-1?(2)0.25 (3)4∶1 (4)逆反应 Qc=0.4>K=0.25
本题解析:(1)I2的物质的量的变化="0.1" mol×20%=0.02mol;则根据化学反应速率=浓度的变化量除以时间可得V(I2)=5×10-4mol·L-1·s-1 ,再根据同一化学反应方程式中,速率之比等于化学计量数之比,所以,v(WI2)5×10-4mol·L-1·s-1 ,
(2)平衡常数=平衡后,生成物浓度幂之积与反应物浓度幂之积的比值,在这个表达式中,固体、纯液体的浓度是一个常数,不列入平衡常数表达式中,所以,可计算求得该反应的平衡常数K=0.25
(3)反应W(s)+I2(g) WI2(g)为等体积反应,若起始时,加入的碘为0.2 mol,则该平衡不移动,所以,平衡时容器中气体的体积比V(I2)∶V(WI2)为原体系下的体积比,在相同条件下,体积之比等于物质的量之比,即可求得V(I2)∶V(WI2)=4∶1
WI2(g)为等体积反应,若起始时,加入的碘为0.2 mol,则该平衡不移动,所以,平衡时容器中气体的体积比V(I2)∶V(WI2)为原体系下的体积比,在相同条件下,体积之比等于物质的量之比,即可求得V(I2)∶V(WI2)=4∶1
(4)判断化学平衡的移动方向可根据浓度商Qc与K的大小分析;若Qc大于K,则向逆反应方向移动;若Qc等于K,则平衡不移动;若Qc小于K,则平衡向正反应方向移动。
本题难度:一般