|
高考化学知识点归纳《物质的量》高频考点强化练习(2019年最新版)(四)
2020-07-07 23:47:14
【 大 中 小】
|
1、选择题 在2 L溶有0.2mol NaCl和0.2mol MgCl2的溶液中,Cl—的物质的量浓度为
A.0.05 mol/L
B.0.1 mol/L
C.0.2 mol/L
D.0.3 mol/L
|
参考答案:D
本题解析:溶液中氯离子的物质的量为0.2+0.2×2=0.6摩尔,所以氯离子的物质的量浓度为0.6/2=0.3mol/L。
考点:物质的量浓度的计算。
本题难度:一般
2、选择题 在0.5mol Na3PO4中含有Na+的数目是
[? ]
A. 3.01×1023
B. 9.03×1023
C. 3.01×1024
D. 9.03×1024
参考答案:B
本题解析:
本题难度:简单
3、选择题 配制250 mL 0.1 mol·L-1盐酸溶液时,下列实验操作会使配制溶液浓度偏高的是( )
A.容量瓶内有水,未经过干燥处理
B.定容时,仰视刻度线
C.用量筒量取浓盐酸时,用水洗涤量筒2~3次,洗液倒入烧杯中
D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线
参考答案:C
本题解析:根据c=n/V可知,容量瓶内有水,未经过干燥处理,但并没有影响n或V,所以对结果无影响;定容时,仰视刻度线,则容量瓶中溶液的体积偏多,因此浓度偏低;选项C中溶质的物质的量增加,所以浓度偏高;D中溶液的体积偏多,则浓度偏低,答案选C。
点评:根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。
本题难度:一般
4、填空题 (8分)实验室要配制200mL 1mol/L NaOH溶液,请回答下列问题。
(1)用托盘天平称取氢氧化钠,其质量为 克。
(2)实验开始前,需要检查容量瓶是否 。
(3)下列主要操作步骤的正确顺序是 。
①称取一定量的氢氧化钠,放入烧杯中,用适量的蒸馏水溶解;
②用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2至3次,洗涤液转移到容量瓶中。
(4)在配制过程中,其他操作都正确,下列操作会引起所配溶液浓度偏低的是: (填序号)
①溶解NaOH固体的过程中,有少量溶液溅出烧杯
②容量瓶不干燥,含有少量蒸馏水
③用于溶解NaOH的烧杯、玻璃棒未洗涤
④定容摇匀后发现液体体积小于刻度线,未补加少量蒸馏水至刻度线
(5)下图是该同学转移溶液的示意图,
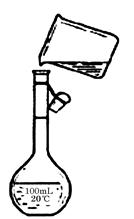
图中的错误是 , 。
参考答案:(8分)
(1)8.0(1分)
(2)漏水(1分)
(3)①③⑤②④(2分)
(4)①③(2分)
(5)未用玻璃棒引流(1分);未采用200 mL容量瓶(1分)。
本题解析:(1)200mL1mol/LnaOH溶液中NaOH的质量是0.2L×1mol/L×40g/mol=8.0g;
(2)实验开始前必须对容量瓶进行检漏,检查容量瓶是否漏水;
(3)根据溶液配制的操作步骤,先将称量的固体溶解;冷却后移入容量瓶;洗涤烧杯玻璃棒2-3次,将洗涤液移入容量瓶;直接向容量瓶内加水,至刻度线2-3cm处改用胶头滴管加水至凹液面与刻度线相切;盖好瓶塞,反复上下颠倒,摇匀;所以正确的顺序是①③⑤①④;
(4)①溶解NaOH固体的过程中,有少量溶液溅出烧杯,导致氢氧化钠的物质的量减少,溶液的浓度偏低,正确;②容量瓶不干燥,含有少量蒸馏水,对结果无影响,因为在配制过程中需直接向容量瓶内加水,错误;③用于溶解NaOH的烧杯、玻璃棒未洗涤,导致氢氧化钠的物质的量减少,溶液的浓度偏低,正确;④定容摇匀后发现液体体积小于刻度线,未补加少量蒸馏水至刻度线,对结果无影响,因为在摇匀的过程中,有部分溶液留在瓶颈处,所以溶液的浓度不变,错误,答案选①③;
(5)该图是将烧杯内的溶液移入容量瓶,而容量瓶是100mL,不符合题意;移液时应用玻璃棒引流,而图中没有,所以图中的错误是未用玻璃棒引流;未采用200 mL容量瓶。
考点:考查溶液的配制与计算,步骤的判断,误差的分析
本题难度:一般
5、选择题 用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4LSO3含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.6.4 g金属铜投入足量盐酸中,失电子总数为 0.2 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA
|