1、计算题 (8分)已知某饱和氯化钠溶液体积为VmL,溶液密度为d g·cm-3,溶质的质量分数为ω%,物质的量浓度为c mol·L-1,溶液中含NaCl的质量为m g。
(1)用ω表示该温度下NaCl的溶解度是?。
(2)用m、V表示溶液的物质的量浓度是?。
(3)用ω、d表示溶液的物质的量浓度是?。
(4)用c、d表示溶液中溶质的质量分数是?。
参考答案:(每空2分)(1)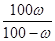 g?(2)
g?(2)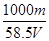 mol/L 或? 17.1m/Vmol·L-1
mol/L 或? 17.1m/Vmol·L-1
(3) 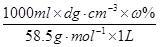 或0.171dωmol·L-1?(4)
或0.171dωmol·L-1?(4) 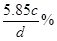
本题解析:考查物质的量的有关计算。
(1)溶解度是在一定条件下,在100g水中溶解达到饱和时所能溶解的质量。由于饱和溶液中溶质的质量分数是ω%,所以溶解度S=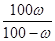 g。
g。
(2)溶液的体积是Vml,含有溶质氯化钠的质量是mg,物质的量是m/58.5mol,所以根据c=n/V可知,溶液的浓度是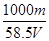 mol/L 或? 17.1m/Vmol·L-1。
mol/L 或? 17.1m/Vmol·L-1。
(3)根据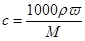 可知,溶液的浓度是
可知,溶液的浓度是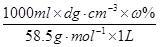 或0.171dωmol·L-1。
或0.171dωmol·L-1。
(4)溶液的质量是Vdg,而溶质的质量是0.001Vcmol,质量是0.001Vcmol×58.5g/mol=0.0585Vcg,所以溶质的质量分数是0.0585Vcg÷Vdg×100%=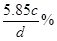
本题难度:一般
2、选择题 在2 L溶有0.2mol NaCl和0.2mol MgCl2的溶液中,Cl—的物质的量浓度为?
A.0.05 mol/L
B.0.1 mol/L
C.0.2 mol/L
D.0.3 mol/L
参考答案:D
本题解析:溶液中Cl-物质的量为0.2 mol +0.2 mol×2=0.6mol,Cl-物质的量浓度为0.3mol/L。
点评:c=n/V,其中n可以代表溶质的物质的量,也可以代表离子的物质的量,V表示溶液的体积。
本题难度:一般
3、填空题 28g KOH配成250mL溶液,溶质的物质的量 ,溶质的物质的量浓度为 。
参考答案:0.5mol,2mol/L.
本题解析: 溶质的物质的量为28g÷56g/mol=0.5mol,物质的量浓度为0.5mol÷0.25L=2mol/L.
考点:物质的量和质量的换算,物质的量浓度的计算。
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数的值。下列叙述正确的是(?)。
A.42 g C3H6中含有的共用电子对数目为8 NA
B.电解饱和食盐水时,当0.1 mol NaCl反应时,转移的电子数为0.1 NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA
参考答案:B
本题解析:有关NA的问题,解答时应对各种“陷阱”了如指掌,避免犯错。A项,注意1个CC中含2对共用电子对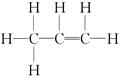 ,1 mol C3H6中含有共用电子对数为9 NA,错误。B项,发生反应2NaCl+2H2O
,1 mol C3H6中含有共用电子对数为9 NA,错误。B项,发生反应2NaCl+2H2O 2NaOH+H2↑+Cl2↑,当0.1 mol NaCl反应时,转移电子数为0.1 NA,正确。C项,状态为常温常压,此时气体的摩尔体积大于22.4 L·mol-1,22.4 L混合气体的分子数小于NA。D项,由于Al3+水解:Al3++3H2O?Al(OH)3+3H+,则阳离子数目大于0.02 NA,错误。
2NaOH+H2↑+Cl2↑,当0.1 mol NaCl反应时,转移电子数为0.1 NA,正确。C项,状态为常温常压,此时气体的摩尔体积大于22.4 L·mol-1,22.4 L混合气体的分子数小于NA。D项,由于Al3+水解:Al3++3H2O?Al(OH)3+3H+,则阳离子数目大于0.02 NA,错误。
本题难度:一般
5、选择题 下列叙述正确的是(?)
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
参考答案:B
本题解析:解答本题时应注意通过物质的量和其他物理量之间的换算关系进行有关计算和判断,同时注意溶液配制时水的体积会发生变化。
选项
具体分析
结论
A
NaCl为离子化合物,不存在NaCl分子
错误
B
1.00 mol? NaCl中含有1.00 mol Na+,而Na+的最外层电子数为8,所以 1.00 mol? NaCl中,所有Na+的最外层电子总数为8×6.02×1023
正确
C
配制溶液时不能直接将溶质溶于一定体积的水中,而应该是溶于少量水中再加水稀释至所需体积
错误
D
电解58.5 g熔融的NaCl,只能得到0.5 mol氯气,即标准状况下11.2 L氯气
错误
本题难度:一般