1、选择题 如图为反应2X(g)+Y(s)  ?2Z(g)的反应过程和能量关系图,下列说法正确的是(?)
?2Z(g)的反应过程和能量关系图,下列说法正确的是(?)
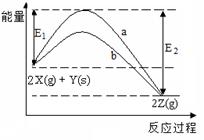
A.曲线a和b表示两个反应过程的反应热不同
B.曲线a一定表示反应是在无催化剂时的反应过程
C.增大压强,X的转化率一定增大
D.反应达到平衡后,升高温度,平衡常数K值一定减小
参考答案:D
本题解析:由盖斯定律知,反应热由始态和终态决定,a和b的初始态和终态一样,故反应热相同;影响反应过程的因素很多,有温度、压强、催化剂等,B中曲线a与b可能使用不同的催化剂所致。
本题难度:一般
2、填空题 (14分)将20g Ba(OH)2·8H2O晶体与10 g NH4Cl晶体一起放入小烧杯中,将烧杯放在滴有3~4滴水的玻璃片上,用玻璃棒迅速搅拌。
(1)实验中玻璃棒的作用是 。
(2)写出有关反应的化学方程式 。
(3)实验中观察到的现象有 、 和反应混合物成糊状。
(4)通过 现象,说明该反应为 (填“吸热”或“放热”)反应,这是由于反应物的总能量 (填“小于”或“大于”)生成物的总能量。
参考答案:(每空2分,共14分)
(1)搅拌使混合物充分接触并反应
(2)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3 ↑+10H2O
(3)玻璃片上结冰而与小烧杯粘在一起,有少许刺激性气味
(4)结冰,吸热,小于
本题解析:
(1)搅拌使混合物充分接触并反应
(2)Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3 ↑+10H2O
(3)玻璃片上结冰而与小烧杯粘在一起,有少许刺激性气味
(4)结冰,吸热,小于
本题对典型的吸热反应进行了考查,学习时注意从①实验目的②原理③原料④装置⑤实验操作⑥实验现象⑦实验结论⑧关键问题讨论等几个方面进行整理。属于记忆理解性内容
本题难度:一般
3、选择题 CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-889.5kJ·mol-1
C2H6(g)+27O2(g)=2CO2(g)+3H2O(l)ΔH=-1583.4kJ·mol-1
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)ΔH=-1409.6kJ·mol-1
C2H2(g)+25O2(g)=2CO2(g)+H2O(l)ΔH=-1298.4kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-2217.8kJ·mol-1
如果1mol上述烃中的两种混合物完全燃烧后放出1518.8的热量,则下列组合不可能是(?)
A.CH4和C2H4
B.CH4和C2H6
C.C3H8和C2H6
D.C3H8和C2H2
参考答案:AC
本题解析:混合烃的平均燃烧热为1518.8kJ,则混合烃之一的燃烧热必大于1518.8kJ,另一烃燃烧热必小于1518.8kJ,代入各选项进行比较,可知正确的选项为A、C。
本题难度:一般
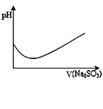
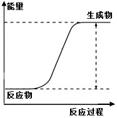
4、选择题 12.下列图示内容的对应说明错误的是
| A
| B
| C
| D
|
图示
| 
| 
| 
| 
|
说明
| 该仪器用于配制一定质量分数的溶液
| 表示溴水中滴入Na2SO3溶液的PH
变化曲线
| 该装置可保护钢闸门不被腐蚀
| 该化学反应为吸热反应
|
参考答案:A
本题解析:A项容量瓶不是用来配制一定质量分数的溶液的,而是用来配制一定物质的量浓度的溶液的。
考点:化学实验方案的评价
点评:本题考查较为综合,涉及内容较多,但难度不大,要注意基础知识的积累。
本题难度:一般
5、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。

(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使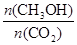 增大的有 。
增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
参考答案:(1)CO2(g)+3H2(g) CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
(2)C(1分) (3) (1分)
(1分)
(4)增大(1分) (5)0.225mol/(L·min)(1分) (6)C(1分)
本题解析:(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应。反应热等于反应物的总能量和生成物总能量的差值,因此该反应的热化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
(2)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0;由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程,即△S<0,所以答案选C。
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据可逆反应可逆反应CO2(g)+3H2(g) CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K=
CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K= 。
。
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大。
(5)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=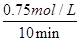 =0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
=0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
(6)使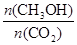 增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,
增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,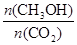 减小,故A错误;B、加入催化剂,平衡不移动,
减小,故A错误;B、加入催化剂,平衡不移动,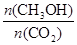 不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,
不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,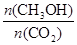 增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,
增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,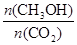 不变,故D错误;答案选C。
不变,故D错误;答案选C。
考点:考查热化学方程式的书写、外界条件对平衡状态和平衡常数的影响、反应速率的计算等
本题难度:困难