1、推断题 A、B、C、D均为氢化物,其分子中所含原子数依次为2、3、4、4。A、C的分子中原子个数比均为1:1,且电子总数均为18;B与C的元素种类相同;B、D的分子均含10个电子,B 与D反应得到一种一元弱碱。 请回答:
(1)A分子的电子式是____________。
(2)实验室制备D的化学方程式是____________________;检验D是否收集满的方法是________________。
(3)实验室利用稀硫酸与过氧化钡发生复分解反应来制备C,该反应的化学方程式是________________。
(4)工业上利用电解KHSO4溶液所得的产物与水反应制备C。电解KHSO4溶液时,阳极反应式是
2HSO4- -2e- = S2O82- +2H+,阴极反应是__________;已知1 mol S2O82- 与水反应得到C时转移了2mol e-,则该反应的离子方程式是___________________。
参考答案:(1)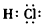
(2)2NH4Cl + Ca(OH)2 CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸接近容器口,观察到试纸变蓝,证明已收集满
CaCl2+2NH3↑+2H2O;用湿润的红色石蕊试纸接近容器口,观察到试纸变蓝,证明已收集满
(3) BaO2+ H2SO4 = H2O2+ BaSO4↓
(4) 2H+ + 2e- = H2↑;S2O82- + 2H2O = H2O2 + 2HSO4-
本题解析:
本题难度:一般
2、选择题 下表所列各组物质中,各物质间能按照下图所示通过一步反应就能完成转化的是
参考答案:B
本题解析:考查的知识点:元素化合物知识
选项A
a→b:Cu与浓H
SO4共热生成CuSO4、SO2、H2O;b→c:CuSO4+2NaOH=Cu(OH)2+Na2SO4
c→b:Cu(OH)2+H2SO4=CuSO4+2H2O,但c→a无法实现,所以A错误
选项B
a→b:Cu与稀硝酸反应生成Cu(NO3)2、NO、H2O;? b→c:2NO+O2=2NO2
c→b:3NO2+H2O=2HNO3+NO,? c→a:3NO2+H2O=2HNO3+NO?所以B正确
选项C
a→b:CH2=CH2与H2O加成;? b→c、c→b、c→a都无法实现?所以C错误
选项D
a→b: Si与氧气共热生成SiO2;? b→c无法实现
c→b:H2SiO3受热分解成SiO2和H2O,? c→a无法实现?所以D错误
本题难度:简单
3、推断题 图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应时加入或生成的水,以及生成沉淀J时的其他产物均已略去)。

请填写下列空白:
(1)物质B是______,F是_______,J是______。
(2)反应①的离子方程式是??。
参考答案:(1)Cl2,Fe,Fe(OH)3
(2)Cl2+2OH-=ClO-+Cl-+H2O
本题解析:
【错解分析】第(1)问:①F是NaCl,J是AgCl。②F是Fe(正确),但J答成Fe(ClO)3。
第(2)问:①Cl2+2NaOH=NaCl+NaClO+H2O。
②Cl2+OH-=Cl-+ClO-+H2O。
③Cl2+2OH-=Cl-+HClO。
④Cl2+2Na++2OH-=Cl-+NaClO+H2O。
⑤Cl2+2NaOH=Cl-+ClO-+H2O。
⑥Cl2+2Na++2OH-=Cl-+ClO-+2Na++H2O
第(1)问:出现①误区,是由于对题干中“粗框表示初始反应物”理解错了,误认为F仍是饱和食盐水,影响了各步的推断,只好凭主观感觉,写J是AgCl。同时也反映出部分同学的思维能力差,在F是“NaCl”推导不下去的时候,应换一种物质,另行推导,及时调整自己的思路,以求出正确的结果。出现②误区,是由于对溶液中发生的水解反应和离子反应不清楚,未考虑到次氯酸是弱酸(比碳酸的酸性还弱),故NaClO水溶液呈碱性,而Fe3+水解,溶液呈酸性,通过水解平衡移动,可得出沉淀物为Fe(OH)3。也没有考虑到Fe3+直接与溶液中OH-结合,生成Fe(OH)3沉淀,故导致了失误。
第(2)问:出现①误区,是由于未审清题意,答非所问,误将离子方程式写成化学方程式,导致失误。出现②误区,是由于离子方程式未作配平检查所致。出现③、④误区,是由于对Cl2与强碱溶液反应的本质未掌握,误认为碱性条件下能生成次氯酸,或把NaClO误认为是弱电解质,导致失误。出现⑤、⑥误区,是由于不掌握离子方程式书写的要点和技能,导致失误。
【正解】审视框图,两个粗框表示初始反应物,第一个粗框中是饱和食盐水,经电解可得NaOH,Cl2和H2,这个反应是大家熟知的,但究竟A,B,C各是何物?还要看与之相关的反应才能判断。据B与A反应生成两种产物,而B与C只生成一种产物,可推知:B为Cl2,C为H2,A为NaOH。至此反应①的离子方程式就能写出来了。
第二个粗框中是F,F与B反应生成I,F与G反应生成H,且H与B反应又得到I,由此可推知:H,I是同种金属的氯化物,F是变价金属元素的单质。头脑中应立即出现三个熟悉的化学反应:2Fe+3Cl2 2FeCl3(B+F→I)
2FeCl3(B+F→I)
Fe+2HCl=FeCl2+H2↑?(G+F→H)
2FeCl2+Cl2=2FeCl3?(B+H→I)
据此得出F就是Fe的结论。
再看I和H,在加入D之后,均得沉淀J,可知D不可能是NaCl,只能是NaClO。NaClO溶液呈强碱性;HClO是很弱的酸,又是氧化性很强的酸;Fe2+会被氧化成Fe3+;Fe3+与OH-在溶液中不能大量共存,会产生Fe(OH)3沉淀,所以无论是FeCl3与NaClO溶液混合,还是FeCl2与NaClO溶液混合,都会得到Fe(OH)3沉淀(J)。
本题难度:一般
4、填空题 (9分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
 (1)W的第一电离能比氧原子的?(填“大”或“小”),W的气态氢化物稳定性比
(1)W的第一电离能比氧原子的?(填“大”或“小”),W的气态氢化物稳定性比 H2O(g) ?(填“强”或“弱”),W的单质分子中含?个∏键;
H2O(g) ?(填“强”或“弱”),W的单质分子中含?个∏键;
 (2)Z位于元素周期表第?周期第?族,Z的基态原子核外电子排布式是?;
(2)Z位于元素周期表第?周期第?族,Z的基态原子核外电子排布式是?;
 (3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 (10分)A为两种固体的混合物,G和I为溶液D的组成成分,E为红褐色沉淀,J为淡黄色固体。反应所加的试剂均足量。

(1)混合物A一定含有的元素为(写元素符号)?;
(2)溶液F一定含有的阴离子为(写离子符号)?;
(3)写出B+G―→J的化学方程式:?
写出溶液C―→溶液D的离子方程式:?;
(4)I溶液I中溶质的阳离子常作净水剂,其作用原理是(用离子方程式表示):
?。
参考答案:(1)Fe、Al、S (2)Cl-、OH-、AlO (3)H2S+2FeCl3===2FeCl2+S↓+2HCl 2Fe2++Cl2===2Fe3++2Cl- (4)Al3++3H2O=Al(OH)3+3H+
本题解析:由E为红褐色沉淀可它为Fe(OH)3,溶液G为FeCl3;溶液I中溶质的阳离子常作净水剂,说明溶液I的溶质为AlCl3,即溶液D的成分为FeCl3、AlCl3。而溶液C经和氯气氧化可得到溶液D,即2Fe2++Cl2===2Fe3++2Cl-,溶液C的成分为FeCl2、AlCl3。
J为淡黄色固体一定是硫,它可由FeCl3和气体B反应得到,说明B为H2S,即:H2S+2FeCl3===2FeCl2+S↓+2HCl。
最终可知混合物A中必含Fe、Al、S三种元素。
本题难度:一般