|
高中化学知识点大全《物质的量》典型例题(四)
2020-07-08 00:05:27
【 大 中 小】
|
1、选择题 0.2 mol某元素的单质直接与Cl2化合后,生成物质质量增加了14.2 g,这种元素的化合价是( )
A.+1
B.+2
C.+3
D.+5
|
参考答案:B
本题解析:14.2 g Cl2的物质的量为: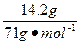 ="0.2" mol,故该元素M与Cl2反应的计量数比为1∶1,即M+Cl2====MCl2,故MCl2中M为+2价。 ="0.2" mol,故该元素M与Cl2反应的计量数比为1∶1,即M+Cl2====MCl2,故MCl2中M为+2价。
本题难度:一般
2、选择题 若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.14 g氮气中含有7NA个电子
C. 1L 0.1mol/L蔗糖溶液中所含分子数为0.1NA
1mol CH3+(碳正离子)中含有的电子数为10 NA
参考答案:B
本题解析:A 错误,与铁反应得到的电子数为2NA
B 正确
C 错误,蔗糖溶液中还含有水分子
D 错误,1mol CH3+(碳正离子)中含有的电子数为9 NA
本题难度:一般
3、简答题 两种常见的单质Ax和By.已知15.5gAx和8.0gBy的原子数相等,且它们的分子数之比为3:4.又知A原子中的中子数比质子数多1,B原子的L层电子数是K层的3倍,计算写出AX、By的化学式.
参考答案:由于“B原子的L层电子数是K层的3倍”,B为氧元素(O),则M(B)=16,
已知15.5gAx和8.0gBy的原子数相等,则15.5M(A)=8.0M(B),所以M(A)=31,
由于“A原子中的中子数比质子数多1”,假设质子数为Z,则Z+(Z+1)=31,Z=15,A为磷元素(P),
因分子数之比为3:4,则15.531x:8.016y=34,解得x:y=4:3,又由于Ax和By是两种常见的单质,则Ax为P4,By为O3.
答:AX、By的化学式分别是P4、O3.
本题解析:
本题难度:一般
4、实验题 (14分) 实验室配制500mL 0.2mol/L的Na2CO3溶液,实际操作步骤有:
①在天平上称量一定量的Na2CO3,放入烧杯,加水溶解;
②把制得的溶液小心地注入500mL容量瓶中;
③继续向容量瓶中加水至距刻度1~2厘米处,改用胶头滴管加水至刻度;
④用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀;
⑤将容量瓶塞塞紧,充分摇匀。填写下列空白:
(1)称量Na2CO3的质量是
(2)操作步骤的正确顺序是(填序号)
(3)本实验使用到的玻璃仪器是
(4)若没有进行④操作,会使结果(填偏高、偏低、无影响,下同)
若用天平称固体时,砝码上沾有油污,则所配制的溶液浓度将 ?
若定容时仰视刻度,则所配制的溶液浓度将?
(5)在进行②操作时,不慎有液体溅出,应该怎样处理?
参考答案:(1)10.6g?(2)①②④③⑤?
(3)500ml容量瓶、烧杯、玻璃杯,胶头滴管
(4)偏低、偏高、偏低?(5)重做
本题解析:(1)500mL0.2mol/L的Na2CO3溶液中溶质的物质的量是0.5L×0.2mol/L=0.1mol。质量是0.1mol×106g/mol=10.6g。
(2)根据配制原理可知,正确的步骤是①②④③⑤。
(3)溶解需要烧杯、玻璃杯。定容需要胶头滴管,容量瓶是对应规格的,即是500ml容量瓶。
(4)如果没有洗涤,则溶质偏少,浓度偏低;砝码上含有油污,则溶质偏多,浓度偏高;定容时仰视刻度线,则溶液的体积偏大,浓度偏低。
(5)在进行②操作时,不慎有液体溅出,则溶质减少,实验失败,需要重新配制。
本题难度:简单
5、选择题 设NA表示阿伏加德罗常数值,下列叙述正确的是
A.NA个氧气分子和NA个氢气分子的质量比为16∶1
B.标准状况下,22.4LH2O含有的分子数为NA
C.11.2L氯气中含有的原子数为NA个
D.2L 1mol/L Na2SO4溶液中Na+离子数为2 N N
参考答案:B
本题解析:略
本题难度:简单
|