1、计算题 (6分)
一定温度下,测得某纯水的pH为6.5。试计算:
(1)此时水的离子积常数Kw为多少?
(2)若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1。的Ba(OH)2溶液,保持原温度,其溶液的pH为多少?
(3)取上述Ba(OH)2溶液200mL,加入含0.01mol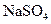 的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
的浓溶液,待反应完全后,上层清液中Ba2+浓度变为多少?[体积变化忽略不计,Ksp(BaSO4)=1.08×10-10]
参考答案:(1) (1分)
(1分)
(2)pH=1(2分)
(3) ?(3分)
?(3分)
本题解析:略
本题难度:简单
2、选择题 t℃时,水的离子积为Kw,该温度下将a mol·L-1一元酸HA与b mol·L-1一元碱BOH等体积混合,混合液一定呈中性的是(?)
A.混合液的pH=7
B.混合液中c(B+)=c(A-)
C.a=b
D.加入甲基橙显橙色
参考答案:B
本题解析:溶液呈中性的本质是c(H+)=c(OH-),HA与BOH混合后溶液中电荷守恒式为c(A-)+c(OH-)=c(B+)+c(H+),B正确。因温度未知,pH=7的溶液不一定呈中性,A错误;若a=b,HA为强酸、BOH为强碱或HA为弱酸、BOH为弱碱且二者电离常数相同,溶液呈中性,C错误;常温下,甲基橙显橙色的溶液3.1<pH<4.4,D错误。
点评:溶液呈中性的本质是c(H+)=c(OH-)。
本题难度:一般
3、选择题 下列排列顺序正确的是
A.常温下水电离出的c(H+):pH =5的CH3COOH溶液>pH =5的盐酸
B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C.等温度等物质的量浓度溶液的pH:Na2CO3>苯酚钠>NaHCO3
D.氢化物的沸点:H2Se>H2S>H2O
参考答案:C
本题解析:A选项中PH=-lgc(H+),当CH3COOH溶液和盐酸PH=5,c(H+)一定相等;B选项中K+和C1-核外电子数都是20,核电荷数越大,离子半径越小,因此微粒半径:Fe(OH)3胶粒>C1->K+>Na+;D选项中氧的氢化物水由于含有氢键,沸点较硫、硒氢化物高,硫化氢、氢化硒是分子化合物,比较式量知硫化氢的沸点低于硒化氢,因此氢化物的沸点:H2O>H2Se>H2S
点评:本次考查的知识点较多,涉及到溶液的PH,粒子半径的比较,物质沸点的比较等,信息量较大,对于物质的性质比较应该落到比较物质的结构,因为化学中结构决定性质。
本题难度:简单
4、选择题 某兴趣小组经实验测定,在1×105 Pa,298 K条件下,1 mol氢气完全燃烧生成水蒸气放出242 kJ热量,下列热化学方程式正确的是? ( )
A.H2O(g)=H2(g)+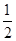 O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+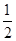 O2(g)=H2O(g) ΔH=+242 kJ·mol-1
O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1
参考答案:A
本题解析:1 mol H2完全燃烧生成水蒸气时放出的热量为242 kJ,故C、D选项中热量值应为负值,不正确;B选项H2O的状态应为气态,不正确;H2O的分解反应与化合反应方向相反,吸热与放热的数值相等。
本题难度:一般
5、填空题 (10分)请判断下列说法是否正确(填“对”或“错”)。
(1)碱性锌锰电池是一次电池,铅蓄电池是二次电池。?
(2)随着温度的升高,纯水的pH增大。?
(3)冰醋酸、纯碱、小苏打分别属于酸、碱、盐。?
(4)镀锌铁制品破损后,镀层仍能保护铁制品。?
(5)醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度。??
(6)25 ℃时,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐。??
(7)用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓?
(8)pH=2与pH=1的硝酸中c(H+)之比为1:10???
(9)Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1 ?
(10)向含有硫酸钙的水垢中加入碳酸钠溶液,沉淀的转化可表示为:?
CaSO4(s)  ?SO42— ?+ Ca2+
?SO42— ?+ Ca2+
CO32—? ?CaCO3(s)
?CaCO3(s)
参考答案:(10分)(1)对?(2)错?(3)错?(4)对?(5)错
(6)错?(7)对?(8)对?(9)错?(10)对
本题解析:电离是吸热的,所以升高温度,水的pH是减小的,②不正确;纯碱是碳酸钠,属于盐,而不是碱,③不正确;醋酸钠溶液中CH3COO-的浓度大,抑制醋酸的电离,⑤不正确;⑥不正确,也可能是酸式盐,例如硫酸氢钠等;碳酸钠溶于水,CO32—水解,所以Na2CO3溶液中c(Na+)与c(CO32-)之比大于2︰1,⑨不正确,其余都是正确的。
点评:本题基础性强,主要是对一些基本概念和基本原理的考查。
本题难度:一般