1、选择题 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是(? )
A.0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠溶液
B.0.1 mol/L的盐酸和0.1 mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=10的氨水
参考答案:BD
本题解析:本题考查了酸碱反应后溶液pH的计算及判断。HCl为一元强酸,NaOH为一元强碱,Ba(OH)2为二元强碱,故等体积等物质的量浓度的HCl与NaOH恰好中和,pH=7,而与Ba(OH)2反应时,Ba(OH)2过量,pH>7,故A错误,B正确;pH=4的醋酸溶液中电离出的c(H+)=1×10-4 mol/L,pH=10的NaOH溶液电离出的c(OH-)=1×10-4 mol/L,因此仅CH3COOH电离出的H+恰好与NaOH中和,还有大量的CH3COOH分子过量,故pH<7,同理,D项中氨水过量较多,溶液显碱性,pH>7,故C错误,D正确。
本题难度:一般
2、选择题 下列说法正确的是(?)
A.加强废电池回收,主要是为了回收电池中的石墨电极
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.把煤粉碎了再燃烧可以提高煤的燃烧效率
D.升高温度可以使吸热反应速率加快,放热反应速率减慢
参考答案:C
本题解析:废电池中常含有镉、铜、铅、镍、铁、锰等多种重金属,汞、镉、铅又是人体不需要的元素,它们一旦进入到人体很难排除掉。目前除汞电池,其他干电池也含汞(汞是作为锌负极的缓蚀剂,目的是为了减轻锌电极的放电时间。通俗地说,也就是增加电池的保质期),选项A不正确;选项B也不正确,一段时间后反应达到平衡或在该条件下达到最大限度了;选项C,增大接触面,使其燃烧完全并加快反应速率;选项D升高温度可以使吸热反应、放热反应速率均加快。
本题难度:简单
3、选择题 将1 mL 0.1mol/L的硫酸加入纯水中制成200 mL溶液,稀释后硫酸中c(H+)水为
A.1×10-13mol/L
B.1×10-3mol/L
C.1×10-7mol/L
D.1×10-11mol/L
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列热化学方程式中的反应热下画线处表示燃烧热的是
[? ]
A.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H= -akJ/mol
B.CH3CH2OH(l)+1/2O2(g)=CH3CHO(l)+H2O(l) △H=-bkJ/mol
C.CO(g)+1/2O2(g)=CO2(g) △H=-ckJ/mol
D.NH3(g)+5/4O2(g)=NO(g)+6/4H2O(g) △H=-dkJ/mol
参考答案:AC
本题解析:
本题难度:简单
5、选择题 已知水的电离平衡曲线如图所示,试回答下列问题:
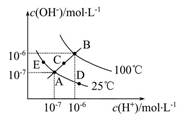
(1)图中五点Kw间的关系是?。
(2)若从A点到D点,可采用的措施是?。
a.升温?b.加入少量的盐酸? c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为?。
参考答案:(1)B>C>A=D=E? (2)b、c? (3)10∶1
本题解析:(1)Kw只与温度有关,温度升高促进水的电离,Kw增大,因此有B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5 mol/L=V(H2SO4)×10-4 mol/L,得V(NaOH)∶V(H2SO4)=10∶1。
本题难度:一般