1、选择题 反应:X(g)+3Y(g)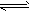 2Z(g) △H <0,在不同温度、不同压强(P2>P1)下,达平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g) △H <0,在不同温度、不同压强(P2>P1)下,达平衡时,混合气体中Z的百分含量随温度变化的曲线应为
[? ]
A.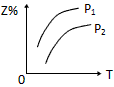
B.
C.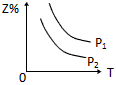
D.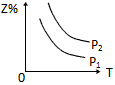
参考答案:D
本题解析:
本题难度:一般
2、选择题 在密闭容器中有反应mA(g)+nB(g)?pC(g)(正反应吸热)处于平衡状态,已知m+n>p,则下列说法正确的是( )
①升温时c(B)/c(C)比值减小②充入C,则A、B的物质的量增大
③充入B,则A的转化率变大④加入催化剂,气体的总物质的量不变.
A.①②
B.②③
C.③④
D.①②③④
参考答案:①正反应为吸热反应,升高温度平衡向正反应方向移动,B的物质的量减小、C的物质的量增大,故c(B)/c(C)比值减小,故正确;
②充入C,平衡向逆反应方向移动,则A、B的物质的量增大,故正确;
③充入B,平衡向正反应方向移动,则A的转化率变大,B的转化率降低,故正确;
④加入催化剂,平衡不移动,反应混合气体的总物质的量不变,故正确,
故选:D.
本题解析:
本题难度:一般
3、选择题 对于可逆反应2SO2(g)+O2(g) 2SO3(g)?△H<0,下列研究目的和图示相符的是
2SO3(g)?△H<0,下列研究目的和图示相符的是
[? ]
A.压强对反应的影响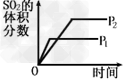
B.温度对反应的影响
C.增加氧气浓度对反应的影响
D.浓度对平衡常数的影响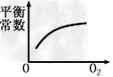
参考答案:C
本题解析:
本题难度:一般
4、选择题 某温度下,体积为1L的密闭容器中分别加入2molX、2molY、1molW、1molZ进行如下可逆反应:X(g)+Y(g)

Z(s)+W(s);△H>0一段时间后反应达到平衡状态,下列叙述正确的是( )
A.加入少量W,逆反应速率增大,平衡向左移动
B.达到同一平衡时,X和Z的浓度可能分别为2.5mol?L-1和1.5mol?L-1
C.若上述反应在绝热系统中进行,反应达平衡,体系的温度一定降低
D.若缩小容器的体积,达到新的平衡时,气体的平均分子量有可能增大
参考答案:A、W在反应中是固体,固体量的增减不会引起化学平衡的移动和化学反应速率的改变,故A错误;
B、达到同一平衡时,可能是向正向进行建立的平衡,也可能是逆向进行建立的平衡,X和Z的浓度不可能都增大,故B错误;
C、如果上述反应在绝热系统中进行,化学平衡的建立是逆向进行建立的,此时过程放热,体系温度是升高的,故C错误;
D、缩小容器的体积,相当于增大压强,则平衡向右进行,气体的平均分子量=mn,反应后气体质量减小,气体物质的量也减小,气体的平均分子量有可能增大,故D正确.
故选D.
本题解析:
本题难度:简单
5、填空题 煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在25℃、101kPa时,H2与O2化合生成1?mol?H2O(g)放出241.8kJ的热量,其热化学方程式为_______。又知:
①C(s)+O2(g)=CO2(g);?△H=-393.5?kJ/mol
②CO(g)+1/2?O2(g)=CO2(g);?△H=-283.0?kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,
C(s)+H2O(g)=CO(g)+H2(g);△H=______kJ/mol。
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g) ?CO2(g)+H2(g);△H<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
?CO2(g)+H2(g);△H<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
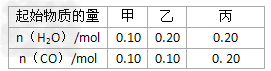
①该反应的平衡常数表达式为______。
②平衡时,甲容器中CO的转化率是_______;容器中CO的转化率;乙______甲;丙______甲。(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度_______(填“升高”或“降低”)。
参考答案:(1)H2(g)+1/2O2(g)==H2O(g) △H=-241.8?kJ/mol ;?+131.3
(2)①K=? ;②50% ;> ;= ③ 降低
;②50% ;> ;= ③ 降低
本题解析:
本题难度:一般