|
|
|
高中化学知识点总结《化学反应与能量》试题巩固(2019年最新版)(六)
2020-07-08 00:12:47
【 大 中 小】
|
1、填空题 (4分)发生化学反应时,破坏化学键需要 能量,形成化学键需要 能量。吸收能量用E1表示,释放能量用E2表示,当E1 E2时,反应吸收能量;当E1 E2时,反应释放能量。
参考答案:吸收 释放 大于 小于
本题解析:略
本题难度:一般
2、选择题 如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

A.加入催化剂,该化学反应的反应热改变
B.b曲线是加入催化剂时的能量变化曲线
C.该反应的热化学方程式为:N2+3H2
|
参考答案:
本题解析:
本题难度:一般
3、选择题 下列各组中的离子,能在溶液中大量共存的是
A.H+、Na+、CO32-、Cl-
B.Ag+、Al3+、NO3-、H+
C.K+、H+、SO42-、OH-
D.Ba2+、Na+、Cl-、SO42-
参考答案:B
本题解析:分析:离子之间发生反应生成气体、弱电解质、沉淀等或发生氧化还原反应、相互促进的水解反应时,则不能大量共存.
解答:A.H+与CO32-反应生成CO2而不能大量共存,故A错误;
B.离子之间不发生任何反应,可以大量共存,故B正确;
C.H+与OH-反应生成H2O而不能大量共存,故C错误;
D.Ba2+与SO42-反应生成BaSO4沉淀而不能大量共存,故D错误.
故选B.
点评:本题考查离子共存问题,题目难度不大,注意离子的性质,做题时要注意题目中所给的隐含信息,如颜色、酸碱性等问题,为考查的主要形式和热点.
本题难度:简单
4、填空题 (共14分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应
| 平衡常数
| 温度(℃)
| 500
| 800
| ①2H2(g)+CO(g) CH3OH(g) CH3OH(g)
| K1
| 2.5
| 0.15
| ②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g)
| K2
| 1.0
| 2.50
| ③3H2(g)+ CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g)
| K3
|
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。

(3)判断反应③△H 0; △S 0(填“>”“=”或“<”)
在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) v(逆)(填“>”“=”或“<”)
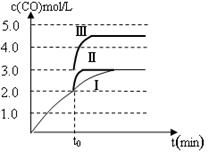
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,
将0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,则混合溶液中离子浓度由大到小的顺序为
参考答案:(共14分)
(1)吸热(1分)
(2)=(1分)
(3)< 、<(各2分);>(2分)
(4)加入催化剂(2分);
将容器的体积快速压缩至2L(2分,只写出加压或缩小容器体积得1分)
(5) c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+)(2分)
本题解析:(1)对于反应②,温度升高,平衡常数增大,说明升高温度对正反应有利,所以该反应是吸热反应;
(2)平衡常数是温度常数,只随温度变化,所以A、B点的温度相同,平衡常数也相同,K(A)=K(B)
(3)反应③=反应①+反应②,所以K3=K1·K2,500℃K3=2.5,800℃ K3=0.375,温度升高,平衡常数减小,说明温度升高对逆反应有利,正向是放热反应,所以△H<0,由化学方程式的系数可知,反应物中气体的总系数是4,生成物的总系数是2,所以△S<0;
(4)t0时刻曲线Ⅰ变为曲线Ⅱ时,CO的浓度未变,到达平衡的时间缩短,说明反应速率加快,平衡不移动,所以改变的条件是加入催化剂;曲线Ⅰ变为曲线Ⅲ时,CO的浓度由2.0mol/L增大到3.0mol/L,浓度增大1.5倍,说明容器的体积由原来的3L迅速缩小1.5倍,变为2L,达平衡时CO的浓度是4.5mol/L,所以改变的条件只能是将容器的体积快速压缩至2L;
(5)0.2 mol/L的乙酸与0.1 mol/LBa(OH)2溶液等体积混合,醋酸与氢氧化钡恰好完全反应,生成醋酸钡溶液,尽管醋酸根离子水解,但醋酸根离子浓度仍大于钡离子浓度,水解使溶液显碱性,所以离子浓度的大小关系是c(CH3COO-)>c(Ba2+)>c(OH-)>c(H+)。
考点:考查化学热效应的判断,化学平衡常数的应用,图像的分析,溶液的离子浓度的比较
本题难度:困难
5、选择题 已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是
A.431 KJ/mol
B.946 KJ/mol
C.649 KJ/mol
D.869 KJ/mol
|
参考答案:B
本题解析:反应热就是断键吸收的热量与成键所释放的能量的差,N≡N+3mol×436 KJ/mol-6mol×391KJ/mol=—92.4 KJ/mol,解得N≡N的键能数值是945.6 KJ/mol,因此选项是B。
考点:考查化学反应过程中的键能与反应热的关系的知识。
本题难度:一般

