|
|
|
高中化学必备知识点《物质的量》试题巩固(2019年最新版)(四)
2020-07-08 00:16:59
【 大 中 小】
|
1、选择题 阿伏加德罗常数为NA,下列叙述中不正确的是 (?)
①12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA
②0.5 mol·L—1 Mg(NO3)2溶液中含有为2NA
③7.8 g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.3 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14
A.①④⑦
B.①③④⑤⑥
C.②③⑤⑥
D.③④⑤⑥
参考答案:C
本题解析:①、石墨烯中每个碳原子被3个六元环公用,故每个六元环实际占有2个碳原子,12克石墨烯含有1摩碳原子,即石墨烯中含有的六元环的个数为0.5 NA,正确;?②未指明溶液的体积,无法计算NO 的数目,错误;③Na2S和Na2O2的摩尔质量都是78g/mol,都含有一个阴离子,7.8 g的固体混合物中含有的阴离子数等于0.1NA,错误;④ SO2和 O2为可逆反应,正确;⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.2 NA,错误;⑥稀硫酸与铜不反应,生成SO2的分子数小于0.1 NA,错误; ⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14,正确;故C正确; 的数目,错误;③Na2S和Na2O2的摩尔质量都是78g/mol,都含有一个阴离子,7.8 g的固体混合物中含有的阴离子数等于0.1NA,错误;④ SO2和 O2为可逆反应,正确;⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.2 NA,错误;⑥稀硫酸与铜不反应,生成SO2的分子数小于0.1 NA,错误; ⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14,正确;故C正确;
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
①12.4g白磷晶体中含有的P-P键数约是0.6 NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.02 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA
A.②③⑤⑥
B.①②③④⑤⑦
C.①③④⑤⑥
D.③④⑤⑥⑦
|
参考答案:A
本题解析:①错,12.4g白磷晶体的物质的量为0.1mol,而白磷的结构为空间正四面体形如图, 即含有的P-P键数约是0.6 NA;②错,电解精炼铜时转移了NA个电子,阳极溶解铜的质量小于32 g,因为阳极溶解的有铜、少量的锌、铁、镍等;③错,7.8 g Na2S和Na2O2的混合物中含有的阴离子数先等于0.1 NA;④正确,2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA,因该反应为可逆反应;⑤错,2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.01 NA ;⑥错,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA,因随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;⑦正确,含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA,因为碳酸根离子要水解; 即含有的P-P键数约是0.6 NA;②错,电解精炼铜时转移了NA个电子,阳极溶解铜的质量小于32 g,因为阳极溶解的有铜、少量的锌、铁、镍等;③错,7.8 g Na2S和Na2O2的混合物中含有的阴离子数先等于0.1 NA;④正确,2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA,因该反应为可逆反应;⑤错,2.9g 2CaSO4·H2O(2CaSO4·H2O式量为290)含有的结晶水分子数为0.01 NA ;⑥错,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1 NA,因随反应的不断进行,浓硫酸会变成稀硫酸,稀硫酸与铜不反应;⑦正确,含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA,因为碳酸根离子要水解;
本题难度:困难
3、选择题 在标准状况下,下列气体含有的分子数最多的是:
A.36.5g HCl
B.22.4L O2
C.4g H2
D.0.5mol SO2
|
参考答案:D
本题解析:略
本题难度:一般
4、填空题 (10分)(1)含10.8gAl3+的Al2(SO4)3中所含的SO42-的物质的量是 。
(2)已知16g A与20g B恰好完全反应生成0.04 mol C和31.76g D,则C的摩尔质量为 。
(3)0.1 mol Na中含 mol e-,在跟足量水反应中失去 mol e-。
(4)标准状况下V L氨气溶解在1L水中,所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则ω= 。
参考答案:(10分,无单位不给分)
(1)0.6 mol (2)106 g/mol (3)1.1 0.1
(4)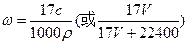
本题解析:略
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是:( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022
参考答案:D
本题解析:A、常温常压下,22.4 L乙烯的物质的量不是1mol,分子中C—H键数不是4NA,A不正确;B、1mol羟基中电子数为9NA,B不正确;C、在反应KIO3+6HI=KI+3I2+3H2O中,碘酸钾中碘元素的化合价从+5价降低到0价,因此每生成3 mol I2转移的电子数为5NA,C不正确;D、硝酸铵溶于水铵根离子水解,因此常温下,1 L 0.1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022,D正确,答案选D。
考点:考查阿伏伽德罗常数的有关计算与判断
本题难度:一般