| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《氧化还原反应中的规律》试题预测(2019年最新版)(二)
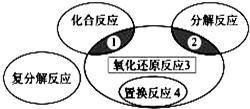 参考答案:A、反应是氧化还原反应,也是化合反应,不属于区域3,故A错误; 本题解析: 本题难度:一般 4、选择题 金属铜的提炼多从黄铜矿开始,黄铜矿的熔烧过程主要反应之一为:2CuFeS2+O2= 参考答案:A.根据质量守恒定律可知,方框中的物质应是Cu2S,反应中S以元素的化合价升高,由-2价升高带+4价,Cu元素的化合价降低,则CuFeS2既作还原剂又作还原剂,故A错误; 本题解析: 本题难度:简单 5、填空题 在?4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O的反应中,还原剂是______,氧化剂是______,每生成lmolCl2转移______mol电子. 参考答案:在4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O的反应中,化合价降低元素是Mn元素,所在的反应物二氧化锰是氧化剂,化合价升高元素是Cl元素,所在的反应物HCl是还原剂,化合价升高数=化合价降低数=转移电子数=2,即每生成氯气1mol,就会转移2mol电子,故答案为:HCl;MnO2;2. 本题解析: 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《铁的氧化物.. | |