|
高中化学知识点归纳《离子共存》练习题(二)
2020-07-08 00:19:47
【 大 中 小】
|
1、选择题 下列各组离子中,在强酸性的透明溶液中能大量共存的是
A.Cu2+、K+、NO3-、SO42-
B.Na+、Ba2+、NO3ˉ、CO32ˉ
C.K+、Na+、Iˉ、NO3ˉ
D.Al3+、Na+、SO42-、HCO3ˉ
|
参考答案:A
本题解析:离子间如果不发生化学反应,则可以大量共存,反之不能。A、在强酸性溶液中Cu2+、K+、NO3-、SO42-可以大量共存,A正确;B、在酸性溶液中碳酸根离子不能大量共存,B错误;C、在酸性条件下硝酸根具有氧化性,能氧化碘离子,不能大量共存,C错误;D、在酸性溶液中HCO3ˉ不能大量共存,D错误,答案选A。
考点:考查离子共存的正误判断
本题难度:一般
2、填空题 (12分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
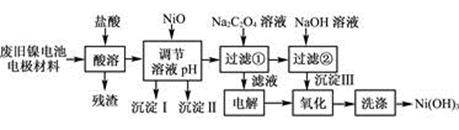
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
M(OH)n
| Ksp
| 开始沉淀pH
| 沉淀完全pH
| Al(OH)3
| 1.9×10-23
| 3.4
| 4.2
| Fe(OH)3
| 3.8×10-38
| 2.5
| 2.9
| Ni(OH)2
| 1.6×10-14
| 7.6
| 9.8
|
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:
???。
(3) 检验电解滤液时阳极产生的气体的方法:
???
???。
(4) 写出“氧化”反应的离子方程式:?
?????。
(5) 如何检验Ni(OH)3已洗涤干净?
???
???。
参考答案:(1) Fe(OH)3 Al(OH)3(各1分,共2分)
(2) NiCl2+Na2C2O4+2H2O=NiC2O4·2H2O↓+2NaCl(3分)
(3) 用湿润的淀粉碘化钾试纸(2分)
(4) 2Ni(OH)2+2OH-+Cl2=2Ni(OH)3+2Cl-(3分)
(5) 取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净(2分)
本题解析:解:(1)根据表中开始沉淀和沉淀完全pH,Fe(OH)3开始沉淀pH=2.5,沉淀完全pH=2.9,Al(OH)3开始沉淀pH=3.4,沉淀完全pH=4.2,故为:Fe(OH)3 Al(OH)3;
(2)NiCl2可与Na2C2O4反应生成NiC2O4?2H2O和NaCl,故方程式为:NiCl2+Na2C2O4+2H2O═NiC2O4?2H2O↓+2NaCl
(3)滤液为氯化钠溶液,电解时阳极产生氯气,氯气有强氧化性,故可用湿润的淀粉碘化钾试纸;
(4)过滤2得到Ni(OH)2电解滤液1产生氯气,二者发生氧化还原反应,离子方程式为2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-,故答案为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-
(5)取最后一次洗涤浸出液,加入硝酸银溶液,若有白色沉淀生成,则说明未洗涤干净,若无白色沉淀,说明已洗涤干净。
点评:本题考查化学反应原理中的电化学,化学方程式的书写,离子的检验等,难度适中。
本题难度:困难
3、选择题 某无色溶液放入铝片后有氢气产生,在该溶液中一定可以大量共存的离子组(?)
A.Na+、K+、Cl-、SO42-
B.Al3+、Na+、NO3-、SO42-
C.Na+、K+、CO32- 、SO42-
D.Na+、K+、HCO3-、SO42-
参考答案:A
本题解析:离子间如果发生氧化还原反应,则不能大量共存,反之是可以的。溶液放入铝片后有氢气产生,则该溶液可能显酸性,也可能显碱性。溶液如果显碱性,则Al3+、HCO3-不能大量共存。如果显酸性,则CO32-、HCO3-不能大量共存。另外,在酸性条件下,NO3-具有氧化性,和Al反应得不到氢气,所以在该溶液中一定可以大量共存的离子组是A,答案选A。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
4、选择题 下列各组离子,在所给条件下一定能大量共存的是
A.在pH=1溶液中:Fe2+、K+、 NO3-、Cl—
B.使紫色石蕊试液变红色的溶液中:K+、Na+、Ca2+、HCO3-
C.在含有大量AlO2—的溶液中: NO3-、Na+、Cl-、Al3+
D.在由水电离出的c(H+)?c(OH—)=10—26的溶液中:K+、Na+、Cl—、SO42-
参考答案:D
本题解析:离子间如果发生化学反应,则不能大量共存,反之可以。A中显酸性,Fe2+和NO3-发生氧化还原反应。B中显酸性,HCO3-不能大量共存。C中铝离子和AlO2—发生反应生成氢氧化铝沉淀,所以正确的答案是D。
本题难度:一般
5、选择题 下列说法中正确的是
[? ]
A.NH4+与HCO3-均可以水解,故NH4HCO3是弱电解质
B.25℃时,1LpH=3的盐酸与l LpH=11的氨水能恰好中和
C.25℃时,用pH试纸测定出某醋酸溶液的pH=3.5
D.25℃时,pH=14的溶液中,Na+、CO32-、K+、ClO-可以大量共存
参考答案:D
本题解析:
本题难度:一般
|