1、选择题 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应;石灰石与盐酸
参考答案:D
本题解析:A、盐酸是强酸、碳酸是弱酸,应该用化学式表示,则氢氧化钠与盐酸、氢氧化钠与碳酸反应的离子方程式分别是H++OH-=H2O、2OH-+CO2=CO32-+H2O,A不正确;B、BaCl2溶液与Na2SO4溶液、Ba(OH)2溶液与H2SO4溶液反应的离子方程式分别是Ba2++SO42-=BaSO4↓、Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓,B不正确;C、碳酸钙是难溶性物质,应该用化学式表示,则Na2CO3溶液与硝酸溶液、CaCO3溶液与硝酸溶液反应的离子方程式分别是CO32-+2H+=H2O+CO2↑、CaCO3+2H+=Ca2++H2O+CO2↑,C不正确;D、石灰石与硝酸反应、石灰石与盐酸反应的离子方程式均是CaCO3+2H+=Ca2++H2O+CO2↑,D正确,答案选D。
本题难度:一般
2、选择题 溶液中下列电离方程式书写正确的是
A.NaHSO4 Na++H++SO42-
Na++H++SO42-
B.NaHCO3===Na++H++CO32-
C.HClO===H++ClO-
D.H2S HS-+H+,HS-
HS-+H+,HS- H++S2-
H++S2-
参考答案:D
本题解析:
正确答案:D
A.强电解质;NaHSO4=Na++H++SO42-
B.HCO3―部分电离;NaHCO3===Na++HCO3-
C.弱电解质:HClO H++ClO-
H++ClO-
本题难度:一般
3、选择题 下列离子方程式正确的是
A.Zn和浓硫酸反应:Zn+2H+=H2↑+Zn2+
B.钠与水反应:Na+2H2O=Na++2OH-+H2↑
C.硫酸铝溶液与过量氢氧化钠溶液反应:Al3+ +4OH—=AlO2-+2H2O
D.向Ca(ClO)2溶液中通入少量CO2:ClO-+H2O+CO2=HClO+HCO3-
参考答案:C
本题解析:A.Zn和浓硫酸反应产物应该有二氧化硫气体生成,错误;B.钠与水反应正确的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;C.正确;D.向Ca(ClO)2溶液中通入少量CO2应该有碳酸钙生成,错误;
本题难度:一般
4、简答题 A、B、C、D都是中学化学中的常见物质,具有如图所示的转化关系(反应条件,其他反应物及多余产物均已略去):
(1)若A是一种白色难溶于水的钙盐,由三种元素组成,C是一种参与植物光合作用的气体.按要求写出下列物质化学式或反应式:
B______;?C+D→A离子方程式:______.
(2)若A是一种无色液体,D是一种金属氧化物,其相对分子质量为232,其中金属元素和氧元素的质量比为21:8.按要求写出下列物质化学式或反应式:B______;?C+D→A化学方程式:______.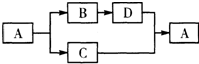
参考答案:(1)A是一种白色难溶于水的钙盐,由三种元素组成,C是一种参与植物光合作用的气体推断为CO2,碳酸钙高温分解生成氧化钙和二氧化碳;氧化钙与水化合生成氢氧化钙;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水.
因此A是碳酸钙,其化学式为CaCO3,B是氧化钙,其化学式为CaO,C是二氧化碳,其化学式为CO2,D是氢氧化钙,其化学式为Ca(OH)2,
C+D→A反应的化学方程式为:CO2+Ca(OH)2═CaCO3+H2O,离子方程式为 CO2+Ca2++2OH-═CaCO3↓+H2O,
故答案为:CaO;CO2+Ca2++2OH-═CaCO3↓+H2O;
(2)因为氧化物由金属和氧元素组成,金属元素与氧元素的质量比为21:8,设金属氧化物化学式为MxOy,
得到①Mx:16y=21:8,②Mx+16y=232;
联立方程计算得到y=4,则x可以取1,2,3分析讨论;
M=168x;
当x=1? M=168;
当x=2? M=84;
当x=3? M=56;
结合计算出的摩尔质量和金属化合价分析判断,金属为Fe;D为Fe3O4,
依据转化关系判断,A为H2O,B为O2,C为H2,D为Fe3O4,
故答案为:O2;4H2+Fe3O4?高温?.?4H2O+3Fe.
本题解析:
本题难度:一般
5、选择题 下列化学反应,能用离子方程式H++OH- = H2O来表示的是
A.硫酸和NaOH溶液
B.醋酸和氢氧化钾溶液
C.盐酸和氢氧化铜
D.稀硝酸和氨水混合
参考答案:A
本题解析:略
本题难度:一般