1、选择题 将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
[? ]
A.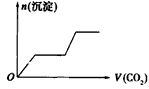
B.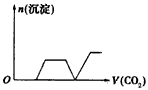
C.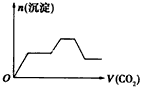
D.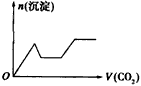
参考答案:C
本题解析:
本题难度:一般
2、填空题 以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
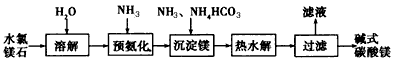
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp= 1.8×l0-11,若溶液中c(OH-) =3.0×10-6mol/L,则溶液中c(Mg2+)=_____
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO20.896 L,通过计算确定碱式碳酸镁的化学式。_____________________________
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数____(填“升高”、“降低”或“不变”)。
参考答案:(1)2.0 mol/L
(2)NH4Cl
(3)
n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00 ×10-2:5.00×10-2 =5:4:5 ,碱式碳酸镁的化学式为:Mg(OH)2·4MgCO3·4H2O
(4)升高
本题解析:
本题难度:一般
3、简答题 镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______,还生成少量的______(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是______,该化合物水解的化学方程式为______;
(3)如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).
下列选项中正确的是______(填序号).
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g);△H=+600kJ?mol-1.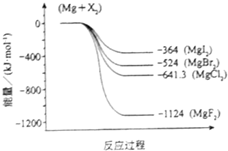
参考答案:(1)镁在空气中燃烧,镁和氧气反应生成氧化镁,和氮气反应生成氮化镁,所以单质镁在空气中燃烧的主要产物是白色的氧化镁,还生成少量的氮化镁,故答案为:MgO;Mg3N2;
(2)CH3MgCl中,Cl元素的化合价是-1价,H元素的化合价是+1价,C元素的化合价是-4价,所以镁元素的化合价是+2价,CH3MgCl水解生成氢氧化镁、氯化氢和甲烷,水解方程式为:CH3MgCl+2H2O=Mg(OH)2+CH4+HCl,
故答案为:+2;CH3MgCl+2H2O=Mg(OH)2+CH4+HCl;
(3)①相同类型的离子晶体中,离子键越大,则离子间作用力越强,物质含有的能量越低,所以MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力,故正确;
②根据图象知,反应物的能量大于生成物能量,所以Mg与F2的反应是放热反应,故正确;
③氯化镁的能量小于溴化镁的能量,氯气的能量大于溴的能量,所以MgBr2与Cl2反应是放热反应,即△H<0,故正确;
④能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故错误;
⑤Mg(s)+F2(l)=MgF2(s)△H=-1124kJ/mol,
Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,
将第二个方程式与第一方程式相减得MgF2(s)+Br2(L)=MgBr2(s)+F2(g);△H=+600kJ?mol-1,故正确;
故选①②③⑤.
本题解析:
本题难度:一般
4、选择题 某学生在实验室做了5个实验:
(1)在铝盐溶液中逐滴加入稀氨水直至过量,
(2)在明矾溶液中加入NaOH溶液直至过量,
(3)在强碱性溶液中逐滴加入铝盐溶液直至过量,
(4)在偏铝酸钠溶液中通 入CO2直至过量,
(5)在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。
并根据以上实验画出下列5种图象(纵坐标为沉淀物质的量,横坐标为溶液中加入 物质的量)实验与图象对立关系正确的是?
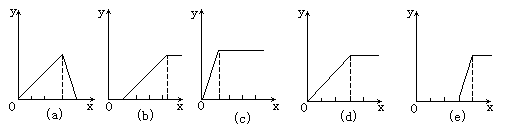
? [? ]
A.(1)和(a)
B.(3)和(e)
C.(2)和(b)
D.(4)和(d)
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列有关镁的叙述正确的是( )
A.镁条燃烧可用CO2进行扑灭
B.镁不能与NaOH溶液反应放出H2
C.镁制容器可用来装浓NHO3
D.镁在空气中燃烧产物全是MgO
参考答案:B
本题解析:
本题难度:简单