1、选择题 在CH3COOH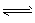 CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
[? ]
A.加入NaOH固体
B.加浓盐酸
C.加水
D.加热
参考答案:D
本题解析:
本题难度:一般
2、选择题 下表是常温下的五种溶液,下列有关叙述中正确的是(? )
?
| ①
| ②
| ③
| ④
| ⑤
|
溶液
| 氨水
| 氢氧化钠
| 醋酸
| 盐酸
| 醋酸钠
|
pH
| 11
| 11
| 3
| 3
| 8.3
|
A.表中五种溶液,其中①~④由水电离出的c(H+):②=④>①=③
B.在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+)
C.分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
参考答案:D
本题解析:A、酸或碱抑制水的电离,且溶液中氢离子或氢氧根离子浓度越高抑制程度越大。能水解的盐促进水的电离。因此根据表中数据可知①~④由水电离出的c(H+):②=④=①=③,A不正确;B、根据电荷守恒可知c(H+)+ c(Na+)=c(Cl-)+c(OH-)+c(CH3COO-),溶液显中性,则c(OH-)=c(H+),所以c(Na+)=c(Cl-)+c(CH3COO-),即c(Cl-)<c(Na+),B不正确;C、氢氧化钠和盐酸是强电解质,完全电离。氨水和醋酸是弱碱、弱酸,部分电离,所以分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>④>③,C不正确;D、将①、④两种溶液等体积混合后氨水过量,溶液显碱性,则所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+),D正确,答案选D。
本题难度:一般
3、选择题 PH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的PH仍然相同,则X、Y、Z的关系是
[? ]
A.X>Y>Z
B.X>Y=Z
C.X<Y=Z
D.X<Y<Z
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列物质中,属于弱电解质的是(?)
A.氨水
B.冰醋酸
C.酒精
D.硫酸钡
参考答案:B
本题解析:电解质是在水溶液中或熔化状态下能够导电的化合物。弱电解质是在水溶液中只有部分电离产生离子的电解质。A.氨水是混合物。错误。B.冰醋酸在水分子的作用下,部分发生电离:CH3COOH CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
本题难度:一般
5、选择题 下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)