|
高中化学知识点大全《弱电解质电离平衡》练习题(八)
2020-07-08 00:28:40
【 大 中 小】
|
1、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA物质的量
浓度(mol·L-1)
| NaOH物质的量
浓度(mol·L-1)
| 混合溶液的pH
| 甲
| 0.2
| 0.2
| pH=a
| 乙
| C1
| 0.2
| pH=7
| 丙
| 0.2
| 0.1
| pH>7
| 丁
| 0.1
| 0.1
| pH=9
|
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,若a?7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度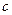 (A-)与 (A-)与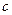 (Na+)的大小关系是?。 (Na+)的大小关系是?。
A.前者大
B.后者大
C.二者相等
D.无法判断
| (3)从丙组实验结果分析,HA是?酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是?。
(4)丁组实验所得混合溶液中由水电离出的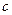  =?mol·L-1。 =?mol·L-1。
参考答案:(每小题3分)(1)>?(2)C?(3)弱? Na+>A->OH->H+?(4)10-5
本题解析:(1)若HA是弱酸,则恰好反应后是强碱弱酸溶液,呈碱性。(2)、根据电荷守恒有:c(Na+)+c(OH-)=c(H+)+c(A-) ,pH=7时,c(OH-)=c(H+),所以c(Na+)= c(A-)。
(3)丙组中HA酸过量,但溶液显碱性,所以HA是弱酸。
(4)因溶液pH=9,c(OH-)=10-6mol/L,全部来源于水的电离。
本题难度:一般
2、选择题 下列哪些能说明醋酸是弱酸的事实( )
(1)醋酸不易腐蚀衣服;
(2)0.1mol/L的CH3COONa溶液的pH约为9;
(3)进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多;
(4)0.1mol/L的CH3COOH溶液pH约为2.9;
(5)相同体积的pH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多;
(6)镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量.
A.(2)(4)(5)(6)
B.(2)(3)(5)(6)
C.(3)(4)(5)(6)
D.全是
参考答案:(1)醋酸不易腐蚀衣服,只能说明醋酸为酸,不能说明为弱酸,故(1)不选;
(2)0.1mol/L的CH3COONa溶液的pH约为9,有弱才水解,水解显碱性,则醋酸为弱酸,故(2)选;
(3)等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多,是因硫酸为二元酸,不能说明醋酸为弱酸,故(3)不选;
(4)0.1mol/L的CH3COOH溶液pH约为2.9,说明醋酸电离不完全,存在电离平衡,则说明醋酸为弱酸,故(4)选;
(5)相同体积的pH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多,说明醋酸的浓度大于10-4mol/L,即醋酸为弱酸,
故(5)选;
(6)镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率是因氢离子结合醋酸根离子结合生成弱电解质醋酸,醋酸的电离是不完全的,随反应的进行醋酸在持续电离,则醋酸为弱电解质,故(6)选;
故选A.
本题解析:
本题难度:简单
3、填空题 (6分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答:
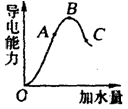
(1)“O”点导电能力为“0”的理由是 。
(2)A、B、C三点pH由大到小的顺序是__________________。
(3)A、B、C三点电离度最大的是_____________。
参考答案:(6分)⑴冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。
(2)C>A>B (3)C
本题解析:
⑴溶液的导电能力与溶液中离子浓度和离子所带电荷有关,冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。⑵由图可以确定溶液中H+浓度由小到大的次序为C、A、B,pH由大到小的顺序是C>A>B;⑶溶液越稀电离程度越大,C点电离度最大。
本题难度:一般
4、选择题 下列事实一定能说明HNO2为弱电解质的是( )
①常温下NaNO2溶液的PH>7?
②10mL1mol/L?HNO2恰好与10mL1mol/LNaOH完全反应
③HNO2与NaCl不能反应
④0.1mol/L?HNO2溶液的PH=2.1.
A.:①②③④
B.:②③④
C.:①④
D.:②④
参考答案:①常温下NaNO2溶液,根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,如果NaNO2是强酸强碱盐,PH=7,而题干中PH>7,说明NaNO2为强碱弱酸盐,故①正确;
②10mL1mol/L?HNO2恰好与10mL1mol/LNaOH完全反应,HNO2和NaOH的物质的量都为0.01mol,无论亚硝酸是强酸还是弱酸,它和氢氧化钠正好1:1反应,与酸是否强弱无关,故②错误;
③HNO2与NaCl不能反应,无论亚硝酸是强酸还是弱酸,它们间都不反应,故③错误;
④0.1mol/L?HNO2溶液的PH=2.1.如果亚硝酸是强酸,0.1mol/L?HNO2溶液的PH应该等于1,而此时PH=2.1,说明电离出的氢离子浓度小,说明HNO2为弱电解质,故④正确;
故选C.
本题解析:
本题难度:一般
5、选择题 用水稀释0.1mol/L的醋酸溶液,其中随水的增加而最终增大的有( )
①H+的物质的量?②c(H+)?③c(OH-)?④ ⑤.
A.①③④
B.①③⑤
C.②④
D.③④
参考答案:A
本题解析:
本题难度:简单
| 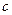
 =?mol·L-1。
=?mol·L-1。