1、填空题 (8分)①—⑩分别代表有关反应物中的一种物质,请完成下列各题:
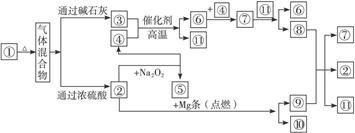
(1)①③④的化学式分别是__________________、___________________、_________________。
(2)⑧与⑨反应的化学方程式是
____________________________________________________。
参考答案:(1)NH4HCO3? NH3? O2
(2)C+4HNO3(浓) 2H2O+4NO2↑+CO2↑
2H2O+4NO2↑+CO2↑
本题解析:由各物质之间转化关系可知,分解产生混合气体的应为不稳定的盐,由反应条件可知气体混合物为二氧化碳、氨气、水蒸气混合物。因此①为NH4HCO3或(NH4)2CO3,②为CO2,③为NH3,④为O2,⑤为Na2CO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,11为H2O。
本题难度:简单
2、选择题 下列关于物质性质的叙述中,正确的是( )
A.Cl2能与金属活动性顺序表中大多数金属反应
B.N2是大气中的主要成分之一,雷雨时,可一步转化为NO2
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D.硅是应用广泛的半导体材料,常温下化学性质活泼
参考答案:A、氯气化学性质活泼,能和大多数金属反应,故A正确;
B、氮气和氧气在雷电的条件下发生反应生成一氧化氮,一氧化氮会被氧气氧化为二氧化氮,但其不能直接转化为二氧化氮,故B错误;
C、硫单质不溶于水,微溶于酒精,易溶于二硫化碳,化合价居于中间价,既有氧化性又有还原性,故C错误;
D、硅属于半导体材料,常温下化学性质不活泼,一般不易和其他物质反应,故D错误.
故选A.
本题解析:
本题难度:简单
3、简答题 (1)有一瓶被漂白过的品红试液,甲同学认为是被Cl2漂白,乙同学则认为是被SO2漂白了,请用简单的实验方法判断出到底哪位同学的猜测是真的______.
(2)25℃时,0.1mol?L-1的醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,[OH-]增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH增大.
①为了验证上述解释哪种正确,继续做如下实验:向0.1mol?L-1的醋酸溶液中加入少量下列物质中的______(填写编号),然后测定溶液的pH.
A、固体CH3COOK?B、固体CH3COONH4
C、气体NH3?D、固体NaHCO3
②若甲同学的解释正确,溶液的pH应______;若乙同学解释正确,溶液pH的值应______填(“增大”、“减小”或“不变”)
参考答案:(1)氯气和二氧化硫的漂白原理不同,前者不可逆,后者可逆,如加热漂白过的试液,如仍变红色,则乙同学对,否则,甲同学对,
故答案为:加热漂白过的试液,如仍变红色,则乙同学对,否则,甲同学对;
(2)①CH3COONH4溶液呈中性,加入CH3COONH4,而其它三种溶液都呈碱性,不能判断甲乙两同学的解释是否正确,
故答案为:B;
②CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使[H+]减小,
故答案为:不变;增大.
本题解析:
本题难度:一般
4、选择题 当不慎有大量Cl2扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某种物质水溶液的毛巾捂住鼻子以防中毒,该物质最适宜采用的是
[? ]
A.NaOH
B.NaCl
C.NaHCO3
D.NH3·H2O
参考答案:C
本题解析:
本题难度:简单
5、填空题 (10分)(I) 海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘:
①在滤液中,滴加几滴硫酸和适量的双氧水?②将海带烧成灰,向灰中加水,加热搅拌?
③加CC14振荡、静置?④过滤?⑤分液。?
(1)合理的操作顺序为?。
(2)步骤③中要用到的玻璃仪器为?,该步分离I2的操作叫?。
(II)向某含有Fe2+、I—、Br—的溶液中缓缓通入适量氯气,溶液中各种离子的物质的量变化如图所示。
(3)AB段表示??离子的减少。
(4)n(Cl2)=2mol时,溶液中反应的离子方程式为?。
参考答案:(I)(1) ②④①③⑤;(2) 分液漏斗;萃取;(II) (3) I-;(4)? Cl2+2Fe2+=2Fe3++2Cl-?。
本题解析:(I)(1) 证明海带中含有碘元素的实验操作方法是②将海带烧成灰,向灰中加水,加热搅拌;④过滤;①在滤液中,滴加几滴硫酸和适量的双氧水;③加CC14振荡、静置;⑤分液。(2)在步骤③中要用到的玻璃仪器为分液漏斗;该步分离I2的操作叫萃取;(II)由于还原性I—> Fe2+>Br—,所以首先发生反应的是I—。反应的离子方程式是?Cl2+2I-===2Cl-+I2;n(I-)=2mol.再通入Cl2,会继续发生反应:Cl2+2Fe2+=2Fe3++2Cl-。当通入Cl2至3mol时,该反应完全,再发生反应:?Cl2+2Br-===2Cl-+Br2.
本题难度:一般