1、选择题 下列说法正确的是( )
A.光照氯水有气泡逸出,该气体是Cl2
B.新制氯水呈黄绿色是因为其中存在Cl2
C.久置氯水遇AgNO3溶液会产生白色沉淀
D.新制氯水经光照一段时间pH增大
参考答案:A、氯水中的次氯酸见光易分解为盐酸和氧气,所以光照氯水有气泡逸出,该气体是O2,故A错误;
B、氯气溶于水中得到氯水,是浅黄绿色的,故B正确;
C、久置的氯水成分是盐酸,含有氢离子和氯离子,向其中加入AgNO3溶液会产生白色沉淀氯化银,故C正确;
D、新制的氯水中的次氯酸见光易分解为盐酸和氧气,新制氯水经光照一段时间,即变为盐酸,酸性增强,pH变小,故D错误.
故选BC.
本题解析:
本题难度:简单
2、选择题 在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中
A.一定含有I-,不能确定是否含有Cl-
B.可能含有NO3-、Cl-和I-
C.可能含有NO3-
D.肯定含有Fe3+
参考答案:A
本题解析:略
本题难度:简单
3、填空题 亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
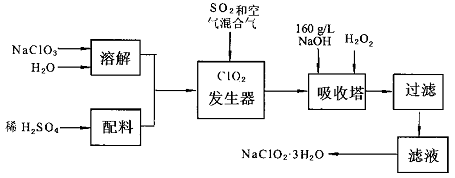
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是?
(2)吸收塔内的反应的化学方程式为?.吸收塔的温度不能超过20℃,其目的是?.
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是?.
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是?.
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为?,原料需要净化的原因是?,阳极产品为?
(2)工业生产NaC1O3的化学方程式为?
参考答案:Ⅰ(1)稀释C1O2以防止爆炸;(2)2NaOH+2C1O2+H2O2=2NaC1O2+2H2O+O2?防止H2O2分解
(3)连续测定吸收塔内溶液的pH;?(4)蒸发,冷却结晶,过滤
Ⅱ.(1)饱和食盐水?防止堵塞离子交换膜?氯气?(2)3Cl2+6NaOH==5NaCl+NaClO3+3H2O
本题解析:(1)发生反应产生的C1O2不稳定易分解爆炸。鼓入空气的作用把它稀释至0%以下安全含量。(2)吸收塔内的反应的化学方程式为:2NaOH+2C1O2+H2O2=2NaC1O2+2H2O+O2。过氧化氢不稳定,高温容易分解。吸收塔的温度不能超过20℃,其目的是防止H2O2分解。(3)判断NaOH是否过量的简单实验方法是测定吸收塔内溶液的pH。(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是先将溶液蒸发水分得到NaC1O2的饱和溶液,再降低温度,利用它的溶解度随温度的升高而增大,随温度的降低而减小的特点,冷却结晶,最后过滤即得NaC1O2·3H2O。II.(1)氯碱工业中的原料为饱和食盐水原料需要净化是因为杂质容易堵塞离子交换膜。阳极产品是氯气。阴极产品是氢气和氢氧化钠。(2)工业生产NaC1O3的化学方程式为3Cl2+6NaOH==5NaCl+NaClO3+3H2O?。2)的制法、氯碱工业的原理及产品的知识。
本题难度:困难
4、选择题 常温常压下,V1L的NO2和O2的混合气体,被水充分吸收后,剩余V2 L氧气,则原混合气体中NO2的体积为
A.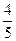 (V1-V2) L
(V1-V2) L
B. (V1+4V2) L
(V1+4V2) L
C. (V1-3V2) L
(V1-3V2) L
D. (4V1+3V2) L
(4V1+3V2) L
参考答案:A
本题解析:二氧化氮与氧气按下式反应:4NO2+O2+2H2O====4HNO3。
本题难度:简单
5、选择题 有KCl和KBr的混合物3.87 g溶于水配成溶液,向溶液中加入足量的AgNO3溶液,得到6.63 g沉淀,则混合物中含K元素的质量分数约为( )?
A.50%
B.30%
C.60%
D.40%
参考答案:D?
本题解析:初步审题,感觉是一道混合物的计算。仔细分析,可以发现KCl和KBr的混合物溶于水配成溶液,向溶液中加入足量的AgNO3溶液,得到沉淀,沉淀是AgCl和AgBr的混合物。3.87 g变成6.63 g,是K元素和Ag元素的质?量差?。?
6.63 g - 3.87 g = 2.76 g?
K ~ ? Ag?Δm?
39? 108? 69?
m(K)? 2.76 g
m(K)=39×2.76 g/108="1.56" g,混合物中含K元素的质量分数: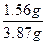 ×100%=40%。
×100%=40%。
本题难度:简单