1、填空题 请回答下列实验室中制取气体的有关问题。
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
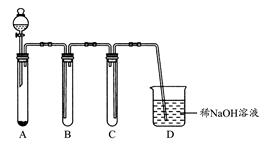
装置B,C,D的作用分别是:B?;C?;D?。
(2)在实验室欲制取适量NO气体。
①下图中最适合完成该实验的简易装置是?(填序号);
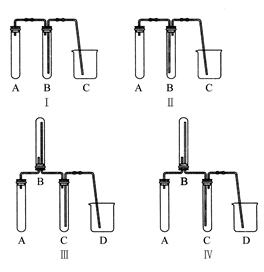
②根据所选的装置完成下表;(不需要的可不填)
?
③简单描述应观察到的实验现象?。
参考答案:(1)向上排气收集氯气 安全作用,防止D中的液体倒吸进入集气管B中 吸收尾气,防止氯气扩散到空气中污染环境
(2)①Ⅰ
②
?
应加入的物质
所起的作用
A
铜屑和稀硝酸
发生NO气体
B
水
排水收集NO气体
C
?
主要是接收B中排出的水
D
?
?
?
③反应开始时,A中铜表面出现无色小气泡,反应速率逐渐加快 A管上部空间由无色逐渐变为浅棕红色,随反应的进行又逐渐变为无色 A中的液体由无色变为浅蓝色 B中的水面逐渐下降,B管中的水逐渐流入烧杯C中
本题解析:(1)因氯气的密度比空气大,所以收集氯气时可用向上排空气法,装置B中导管是长进短出,装置C中导管是短进长出,则B,C装置能用于收集氯气的只能是装置B。装置D中盛有的稀NaOH溶液,能够吸收Cl2及挥发出的HCl。(2)实验室中可用铜与稀硝酸制取NO,因NO极易被氧化,所以收集NO不能用排空气法,应用排水法收集,可选用图I作制取NO气体的简易装置。A为NO的发生装置,加入的物质为铜屑和稀硝酸;B为排水法收集NO气体的装置,加入的物质为水;C主要是接收B中排出的水。
本题难度:简单
2、选择题 Cl2和SO2都具有漂白作用,若将等物质的量的这两种气体混合通入品红与BaCl2的混合液,能观察到的现象是( )
A.溶液很快褪色
B.溶液不褪色
C.出现沉淀
D.不出现沉淀
参考答案:Cl2和SO2等物质的量混合通入品红与BaCl2的混合液中发生反应Cl2+SO2+2H2O=H2SO4+2HCl,生成的H2SO4和BaCl2反应生成BaSO4白色沉淀,Cl2和SO2按1:1恰好反应,所以品红不会褪色,故选BC.
本题解析:
本题难度:一般
3、选择题 下列操作中加入(或通入)试剂至过量,最后无沉淀生成的是
A.将CO2通入饱和Na2CO3溶液中
B.将CO2通入Na2SiO3溶液中
C.将SO2通入Ba(NO3)2溶液中
D.将CO2通入漂白粉溶液中
参考答案:D
本题解析:A项中生成NaHCO3。B项中生成H2SiO3。C项中H2SO3为中强酸,电离产生H+,HNO3把硫从+4价氧化为+6价,生成BaSO4沉淀。D项中,先生成CaCO3,后生成Ca(HCO3)2。
本题难度:简单
4、选择题 下列各组气体可用同一发生装置制取的是
A.Cl2和O2
B.H2和O2
C.H2和CO2
D.Cl2和HCl
参考答案:CD
本题解析:Cl2、HCl符合固+液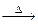 气体模式,H2和CO2符合固+液
气体模式,H2和CO2符合固+液 ↑,O2为固
↑,O2为固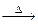 ↑,所以C、D项正确.
↑,所以C、D项正确.
本题难度:简单
5、填空题 下表是实验室制备气体的有关内容:
编号
| 实验内容
| 实验原理
| 气体发生装置
|
①
| 制氧气
| H2O2―→O2
| ?
|
②
| 制氨气
| NH4Cl―→NH3
| ?
|
③
| 是氯气
| HCl―→Cl2
| ?
|
?
(1)上表气体中:从制备过程看,必须选择合适的氧化剂才能实现的是________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是________。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。

(3)若用上述制备O2的装置制备NH3,则选择的试剂为________________。
(4)制备Cl2需用8 mol·L-1的盐酸100 mL,现用12 mol·L-1的盐酸来配制。
①为提高配制的精确度,量取浓盐酸的仪器可选用下列中的________(填序号):
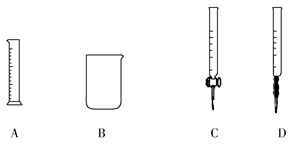
②配制过程中,除上图所列仪器外,还需要的仪器有________、________、________。
参考答案:(1)Cl2 NH3
(2)
编号
发生装置
①
D
②
B
③
A或D
?
(3)浓氨水和固体氢氧化钠(或生石灰等)
(4)①C ②100 mL容量瓶 胶头滴管 玻璃棒
本题解析:由HCl制备Cl2需要加氧化剂才能实现,制氧气、氯气均为氧化还原反应,制氨气为复分解反应。A、B、C、D四套装置分别可以用来进行的反应为:固体(液体)+液体需要加热,固体+固体需要加热,块状固体+液体不需要加热,固体(液体)+液体不需要加热。要提高量取液体的精确度应该用滴定管,取盐酸应该用酸式滴定管。
本题难度:一般