1、选择题 炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附。取一块制作炭雕的下脚料,进行下面的实验。下列有关叙述不正确的是(? )

A.将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体
B.将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色
C.将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体
D.将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应
参考答案:D
本题解析:炭雕具有活性炭的性质,在空气中能够燃烧产生CO2,具有吸附性,既能吸附有害气体,也能吸附有色物质,加热条件下还具有碳的还原性,故选项A、B、C正确,选项D错误。
本题难度:简单
2、选择题 氯化溴是由两种卤素互相结合而成的卤素互化物,其化学性质与Cl2的相似,
能与金属和非金属反应生成卤化物,也能与水反应:BrCl+H2O====HCl+HBrO,下列有关BrCl的性质的叙述中不正确的是
A.有较强的氧化性
B.沸点介于Br2与Cl2之间
C.能使润湿的淀粉碘化钾试剂变蓝
D.BrCl与水反应中既是氧化剂,又是还原剂
参考答案:CD
本题解析:BrCl+KI====KBr+ICl,无单质碘生成,则不能使淀粉显蓝色。与水反应中化合价没有变,既不是氧化剂,又不是还原剂。
本题难度:简单
3、填空题 agH2和bgCl2混合点燃反应后,将反应后所得的气体通入足量NaOH溶液中,求
(1)通入NaOH溶液后,可能剩余的气体的质量。
(2)溶液中可能生成NaCl的质量。
参考答案:(1)剩余气体为H2,其质量为(a- )g(2)生成NaCl质量为:117b/71g或 a+b-(a/2)×2×18 g或(b/35.5)×58.5g或[(a/2)×2+(b-a)/71]×58.5g
)g(2)生成NaCl质量为:117b/71g或 a+b-(a/2)×2×18 g或(b/35.5)×58.5g或[(a/2)×2+(b-a)/71]×58.5g
本题解析:分三种情况讨论,①H2,Cl2等物质的量,恰好反应②H2过量③Cl2过量。
(1)①H2,Cl2等物质的量,恰好反应,H2+Cl2 2HCl,没有气体剩余。
2HCl,没有气体剩余。
②H2过量时,剩余气体为H2,其质量为(a- )g
)g
③Cl2过量时,由于Cl2能与NaOH反应Cl2+2NaOH=NaClO+NaCl+H2O,故无气体剩余。
(2)溶液中可能生成NaCl的质量为
①当a/2=b/71时, 生成NaCl质量117b/71g或 a+b-(a/2)×2×18 g
②a/2>b/71时, 生成NaCl质量 (b/35.5)×58.5 g
③当a/2<b/71时,生成NaCl质量 [(a/2)×2+(b-a)/71]×58.5 g
本题难度:简单
4、填空题 某校课外小组的学生,利用排饱和食盐水的方法收集了一平底烧瓶的氯气,同时制备了一平底烧瓶的饱和氯水,探究完成以下性质实验。请按照要求完成下列问题:
(1)按如图安装好实验装置,U形管内盛有有色墨水,A、B两端液面相平,平底烧瓶盛满氯气。通过分液漏斗向平底烧瓶中滴加少量氢氧化钠溶液,观察到实验现象是?、?。请简单解释原因?。
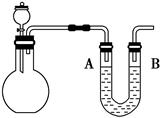
(2)如图所示,平底烧瓶盛满饱和氯水,当日光照射到盛有饱和氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是?;当氯水中不再产生气泡时,某学生欲检验该反应所产生的气体,该同学可采取的合理操作是?。

?
参考答案:(1)平底烧瓶内气体的颜色变浅,U形管A端水位上升,B端水位下降 Cl2与氢氧化钠溶液反应,导致气体颜色变浅,同时平底烧瓶中气体压强减小,使U形管A端水位上升,B端水位下降
(2)氯水中含有次氯酸,次氯酸见光易分解,产生盐酸和氧气,使平衡Cl2+H2O HCl+HClO向右移动,氯水中氯气分子减少,导致溶液颜色变浅 将平底烧瓶盖上玻璃片,取出正放置在桌面上,移去玻璃片,将带火星的木条插入平底烧瓶的瓶口,木条复燃
HCl+HClO向右移动,氯水中氯气分子减少,导致溶液颜色变浅 将平底烧瓶盖上玻璃片,取出正放置在桌面上,移去玻璃片,将带火星的木条插入平底烧瓶的瓶口,木条复燃
本题解析:(1)Cl2是黄绿色气体,Cl2与少量氢氧化钠溶液反应,消耗部分Cl2,气体颜色变浅,同时平底烧瓶中气体压强减小。(2)次氯酸见光分解,产生HCl和氧气,平衡Cl2+H2O?HCl+HClO右移,氯气与水反应又会产生次氯酸,导致氯水中氯气分子减少。使用带火星的木条检验氧气。
本题难度:简单
5、实验题 (8分)将一定量氯气通入刚吸收过少量SO2的NaOH溶液,所得溶液仍显强碱性。
(1) 请完成SO2与过量NaOH溶液反应的化学方程式?
(2) 所得溶液中一定存在的阴离子为SO42—和?
(3) 设计实验方案,探究所得溶液中是否含有SO32-或ClO—。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、0.01 mol·L-1KMnO4、淀粉-KI溶液、紫色石蕊 试液.
试液.
参考答案:(8分)(1) SO2+2NaOH = Na2SO3+H2O? ?(
?( 2) Cl—、OH—
2) Cl—、OH—
(3)
实验步骤
 预期现象和结论
预期现象和结论
步骤2:在A试管中滴加紫色石蕊试液
若先变红后退色,证明有ClO-,否则无
步骤3:在B试管中滴加0.01mol L
L -1KMnO4溶液
-1KMnO4溶液
若紫红色退去,证明有SO32-,否则无
本题解析:略
本题难度:一般