| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《离子方程式的书写及正误判断》高频考点巩固(2019年模拟版)(四)
参考答案:C 本题解析:A、缺少了Ba2++SO42-=BaSO4↓,应写成:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,错误;B、铜与稀硝酸反应生成一氧化氮,应写成:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,错误;C、氢氧化铝是两性的,不溶于弱碱,而溶于强碱,因此离子反应方程式:Al3+ + 3NH3?H2O === Al(OH)3↓+ 3NH4+ ,正确;D铁比铜活泼,铜不能把铁置换出来,应写成:2Fe3++Cu=2Fe2++Cu2+。 本题难度:一般 3、选择题 能正确表示下列反应的离子反应方程式为 |
参考答案:B
本题解析:A、醋酸是弱电解质,应该用化学式表示,A错误;B.向FeBr2溶液中通入足量氯气亚铁离子和溴离子均被氧化,离子方程式正确,B正确;C.NH4HCO3溶于过量的NaOH溶液中生成碳酸钠和一水合氨,离子方程式错误,C错误;D.向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,则此时铝离子恰好形成偏铝酸钠,离子方程式错误,D错误,答案选B。
考点:考查离子方程式的正误判断
本题难度:一般
4、选择题 下表中评价合理的是
参考答案:B
本题解析:A、硝酸与金属或还原性物质反应不能生成氢气,错误;B、离子方程式中难溶物质写化学式,碳酸镁是不溶物,写不能拆分,正确;C、漏写了铵根和氢氧根离子的反应,错误;D、Fe2+还原性强于Br-,Fe2+先于氯气反应,该反应氯气不足但可以根据Fe2+与 Cl2的计量数关系判断出方程式正确,错误。
考点:考查离子方程式的正误判断有关问题。
本题难度:一般
5、填空题 (15分)铝及其化合物用途广泛
(1)铝元素的离子结构示意图为
(2)下列实验能说明Al的金属性(原子失电子能力)小于Na的是 (填序号)。
a.分别将Na和Al同时放人冷水中
b.测定等物质的量的Na和A1与酸反应生成H2的体积
c.向Al(OH)3悬浊液中加人足量NaOH溶液
d.用pH计测量NaCl溶液与AlC13溶液的pH
(3)工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,每生产1吨Al,阳极大约会损失0.6吨的石墨,则石墨被氧化为 (填化学式)。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为____
(5)室温下,往0.2 mol·L-1 Al2 ( SO4)3溶液中逐滴加人1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化的曲线如图所示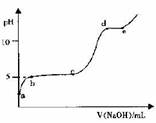
①a点溶液呈酸性的原因是(用离子方程式表示)_______
②c→d时,A1元素的主要存在形式是 (填化学式)
③根据图中数据计算,A1(OH)3的KSP ≈ 。
参考答案:(1) 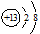 (2)a、c、d (3)CO、CO2
(2)a、c、d (3)CO、CO2
(4)2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1
(5)①Al3++3H2O Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
Al(OH)3 +3H+ ②Al(OH)3 ③4×10-28
本题解析:(1)铝是13号元素,最外层有3个电子,在化学反应中失去3个电子形成铝离子,铝离子的原子结构示意图是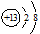
(2) 元素金属性强弱判断依据为看金属与酸或水反应的剧烈程度,反应速率越快,越剧烈,金属性越强,a.分别将Na和Al同时放人冷水中,钠与水剧烈反应,铝几乎不反应,说明钠的金属性强于铝,正确;b.测定等物质的量的Na和A1与酸反应生成H2的体积,与钠、铝失电子数有关,与金属性强弱无关,错误;Al(OH)3能溶于NaOH,说明Al(OH)3是弱碱,NaOH是强碱,所以钠的金属性强于铝,正确;d.用pH计测量NaCl溶液与AlC13溶液的pH,NaCl溶液的PH=7,是强酸强碱盐,AlCl3溶液的PH<7属于强酸弱碱盐,说明Na的金属性强于铝,正确;选a、c、d。
(3)根据化学反应2Al2O3 4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
4Al+3O2,每生产1吨Al,阳极产生8/9吨氧气,若只生成CO,2C + O2 = 2CO大约会损失石墨=(24×8/9)÷32=2/3吨,若只生成CO2 ,C + O2 = CO2,大约会损失石墨=(12×8/9)÷32=1/3吨,实际上损失0.6吨的石墨,所以石墨被氧化为CO和CO2。
(4)碳在高温下与Al2O3反应生成Al4C3固体和CO2,化学方程式为2Al2O3+6C=Al4C3+3CO2,转移电子12e-,已知该反应每转移1 mol电子,吸热a kJ,该反应的热化学方程式为2Al2O3(s)+6C(s)=Al4C3(s)+3CO2 (g) △H="+12" akJ·mol-1。
(5)①a点是硫酸铝溶液,属于强酸弱碱盐,铝离子水解导致溶液呈酸性,用离子方程式表示为Al3++3H2O Al(OH)3 +3H+,
Al(OH)3 +3H+,
②在c→d段pH逐渐增大,说明沉淀逐渐溶解,到达d点,Al(OH)3沉淀已完全溶解,所以c→d时,A1元素的主要存在形式是Al(OH)3。
③向硫酸铝溶液中加入NaOH,当PH=5时开始出现Al(OH)3沉淀,说明此时建立了沉淀溶液平衡,OH-的浓度为10-9mol/L假如,铝离子浓度不变,为0.4mol/L,则A1(OH)3的KSP ≈0.4×[10(-9)]3=4×10-28。
考点:考查铝及其化合物的性质。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《有机物的命.. | |