1、实验题 在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:

(1)阳极上的电极反应式为?。
(2)阴极上的电极反应式为?。
(3)原上层液体是?。
(4)原下层液体是?。
(5)搅拌后两层液体颜色发生变化的原因是?。
(6)要检验上层液体中含有的金属离子?,现象是?。
2、填空题 (15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
3、填空题 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)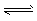 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________ 0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________ 0。(填“>、<或=”下同)
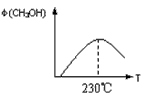
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO 和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的____________ 倍。
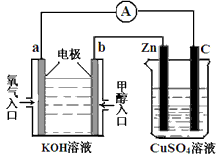
(3)利用甲醇燃料电池设计如下图所示的装置: ①则该装置中b为________ 极,写出装置中电解池内发生反应的离子方程式____________ , ②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为____________ L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)== C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)== C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式______________ 。
4、填空题 (16分)碳及其化合物应用广泛。
I 工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)  CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
(1)向1L恒容密闭容器中注入CO(g)和H2O(g),830℃时测得部分数据如下表。则该温度下反应的平衡常数K=______________。
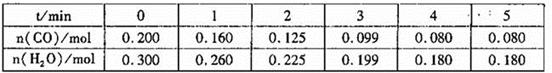
(2)相同条件下,向1L恒容密闭容器中,同时注入2mol CO、2mol H2O(g),1molCO2和1mo1H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
(3)上述反应达到平衡时,要提高CO的转化率,可采取的措施是_______(填字母代号)。
A.升高温度
B.加入催化剂
C.增大压强
D.增加CO的浓度
