| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《盐类水解的原理》试题巩固(2019年最新版)(八)
参考答案:A 本题解析:S2-+H2O=OH-+HS-,S2—的水解平衡逆向移动,[K+]/[S2—]的比值变小。①氢离子浓度增大,使水解平衡正向移动,错误;②氢氧根离子浓度增大,使水解平衡逆向移动,正确;③②氢氧根离子浓度增大,使水解平衡逆向移动,但K+浓度增大,错误;④HS-浓度增大,使水解平衡逆向移动,正确;⑤加水稀释,各离子浓度都减小,平衡正向移动,S2-数目减少,[K+]/[S2—]的比值增大。 本题难度:一般 2、选择题 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( ) |
参考答案:B
本题解析:根据电荷守恒可知,c(OH-)+2c(SO42-) = c(H+)+c(NH4+).由于pH=7,说明c(OH-) = c(H+),所以c(NH4+)=2c(SO42-),答案选B。
本题难度:一般
3、选择题 已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COOH溶液,下列说法正确的是
A.CH3COONa溶液中,c(CH3COO-)> c(Na+) >c(OH-) >c(H+)
B.在相同条件下,两溶液的pH大小为:CH3COONa<NaF
C.两溶液相比较,CH3COONa溶液中的离子总数多
D.CH3COONa溶液中,c(H+)+c(CH3COOH)=c(OH-)
参考答案:D
本题解析:由HF比CH3COOH易电离可知,HF酸性大于醋酸。A选项,应为c(Na+)>c(CH3COO-)>c(OH-) >c(H+),错误。B选项,由于HF酸性大于醋酸,故两溶液的pH大小为:CH3COONa>NaF。错误。C选项,两溶液相比较,由于醋酸根水解程度大于F-,故CH3COONa溶液中的离子总数小于NaF的离子总数。错误。D选项,正确。
考点:离子浓度比大小。盐类水解。
本题难度:困难
4、选择题 下列说法错误的是
A.25℃时,pH=9的NaHA溶液中: c(A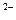 )< c(H2A)
)< c(H2A)
B.25℃时,pH=9的NaHA溶液中: c(H+)十c(H2A)= c(OH
c(OH
参考答案:
本题解析:
本题难度:一般
5、填空题 (14分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
请回答下列问题:
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)步骤⑤的操作为 。
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
参考答案:(每空2分,共14分)
(1)2NH4+MgO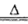 Mg2++2NH3↑+H2O
Mg2++2NH3↑+H2O
(2)抑制Mg2+水解,以便得到较纯的产品
(3)能
(4)蒸发浓缩、冷却结晶
(5)MgCO3+H2O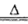 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
(6)蓝色
(7)Al2Mg6(OH)16CO3·4H2O
本题解析:(1)根据流程图可知,硫酸铵与MgO加热产生的气体可与硫酸反应有生成硫酸铵,所以该气体为氨气,所以MgO与铵根离子水解生成的氢离子反应,促进铵根离子的水解,家入围生成氨气,则硫酸铵与MgO在加热条件下反应生成氨气和镁离子、水,离子方程式是2NH4+MgO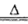 Mg2++2NH3↑+H2O;
Mg2++2NH3↑+H2O;
(2)得到的溶液为硫酸镁溶液,因为镁离子水解,生成氢氧化镁和硫酸,所以调节溶液的pHpH=6.0~6.5的目的是抑制Mg2+水解,以便得到较纯的产品;
(3)虽然镁离子水解生成氢氧化镁和硫酸,但硫酸是高沸点酸,不易挥发,则水解不会进行彻底,所以加热硫酸镁晶体能得到无水MgSO4固体;
(4)从溶液中得到晶体的操作为蒸发浓缩、冷却结晶,过滤,所以步骤⑤的操作为蒸发浓缩、冷却结晶;
(5)长时间加热MgCO3悬浊液后生成Mg(OH)2,同时有二氧化碳生成,化学方程式是MgCO3+H2O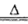 Mg(OH)2+CO2↑;
Mg(OH)2+CO2↑;
(6)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,设氢氧化镁的饱和溶液中氢氧根离子的浓度为x,则5.6×10-12=0.5x×x2,x近似为10-4mol/L,氢氧化镁的饱和溶液的pH近似等于10,所以25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色;
(7)根据实验一可知该碱式碳酸盐3.01g充分灼烧至恒重,生成水和二氧化碳的总质量是1.30g,根据实验二可知,生成的二氧化碳的物质的量是0.112L/22.4L/mol=0.005mol,其质量是0.005mol×44g/mol=0.22g,则水的质量是1.30g-0.22g=1.08g,则水的物质的量是1.08g/18g/mol=0.06mol;根据实验三可知,生成的氢氧化镁的质量是1.74g/mol,则3.01g固体中MgO的物质的量是1.74g/58g/mol=0.03mol,所以氧化铝的质量是(3.01-1.30-0.03mol×40g/mol)g=0.51g,所以Al2O3的物质的量是0.51g/102g/mol=0.005mol,则该药品中Al2O3:MgO:H2O:CO2=0.005:0.03:0.06:0.005=1:6:12:1,所以该药品的化学式是Al2Mg6(OH)16CO3·4H2O。
考点:考查对流程图的分析,基本操作的判断,物质化学式的计算
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《原子核外核.. | |