1、填空题 (1)有人将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
①通甲烷的铂丝为原电池的______极,发生的电极反应为______.
②该电池工作时(放电)反应的总化学方程式为______.
(2)X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为______;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为______
③将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为______.
参考答案:(1)①燃料燃烧时失电子发生氧化反应,原电池的负极上失电子发生氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
故答案为:负;CH4+10OH--8e-=CO32-+7H2O;?
②甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH-=CO32-+3H2O;
故答案为:CH4+2O2+2OH-=CO32-+3H2O;
(2)①Y是短周期非金属元素的单质且常温下为固体,和Z反应生成气体,所以Y只能是S;硫和非金属单质反应且生成的物质是气体,所以非金属单质为氢气、氧气,A在空气中充分燃烧可生成B,所以A硫和氢气反应的产物,B是硫和氧气反应的产物,从而确定X是氢气,Z是氧气,A是硫化氢,B是二氧化硫.
故答案为:SO2;
?②H2S是二元弱酸,能和氢氧化钠反应生成硫化钠和水,当硫化氢过量时硫化钠和硫化氢反应生成硫氢化钠.
故答案为:H2S+OH-=HS-+H2O;
③氯气有强氧化性,二氧化硫既有氧化性又有还原性,当遇到强氧化剂时,二氧化硫作还原剂被氧化,所以二氧化硫和氯气的水溶液反应生成盐酸和硫酸.
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
本题解析:
本题难度:一般
2、推断题 胃酸过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作 用。(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是?(填化学式);乙中含有的主要化学成份是?(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:?。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:
?;?。
参考答案:(每空2分,共10分)(1)NaHCO3; Al(OH)3 ?
(2) HCO3- + H+ = H2O +CO2↑?
(3) Al(OH)3+ 3H+ = Al3+ + 3H2O? Al(OH)3+ OH- = AlO2- + 2H2O
本题解析:(1)遇酸及酸性药物则产生二氧化碳,说明含有碳酸根离子或碳酸氢根离子,水溶液呈弱碱性,说明是强碱弱酸盐,灼烧时火焰为黄色,说明含有钠离子,白色结晶状粉末,受热可缓缓分解,碳酸钠不会分解,所以只能是碳酸氢钠;可溶于稀酸或氢氧化钠溶液中,该物质是一种两性碱,凝胶本身覆盖于溃疡面上,具有保护作用,说明该物质遇水会生成胶状物质,所以该物质是氢氧化铝,故答案为:NaHCO3;Al(OH)3;
(2)碳酸氢钠和盐酸的反应实质就是碳酸氢根离子和氢离子会生成水的反应,故答案为:HCO3-+H+═H2O+CO2↑。
(3)乙是Al(OH)3是两性氢氧化物,既可以与酸反应也可以与碱反应。
点评:在解此类题时,首先读懂题意,然后结合学过的知识和题中的知识进行解答,需要注意物质的量的求解。
本题难度:简单
3、填空题 (14分)已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁, D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18。下列框图中部分反应条件已略去。

试回答下列问题:
(1)下列有关X的说法正确的是?.
A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键?
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为?,D的分子式?,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是?。(填序号)
(3)写出反应②的化学方程式:?。
(4)J与过量H的稀溶液反应的离子方程式为?。
参考答案:1)AB(2分)(2)N2电子式略,H2SO4,④(各2分)
(3)4NH3 + 5O2? ?4NO +6 H2O(3分)
?4NO +6 H2O(3分)
(4)3Fe3O4 + 28H+ + NO3- = 9Fe3+ + NO↑+ 14H2O(3分)
本题解析:略
本题难度:简单
4、选择题 如图,B为常见金属或非金属单质,有下列转化关系

若C是可用作自来水消毒的气体,D、E都是二元化合物(由两种元素组成),D转化为E时,增加的氧的质量约是D物质总质量的25.8%,则A是
[? ]
A.AlCl3?
B.H2O2
C.KCl?
D.NaCl
参考答案:D
本题解析:
本题难度:一般
5、推断题 A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如下图所示(部分产物略去)。

(1) 若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如下图,请写出反应的热化学方程式: ______________________________________________________。

(2)若A为金属单质,D是某强酸的溶液,则反应的离子方程式是___________________________________________。
(3)若A、B为盐,D是强碱,A的水溶液显酸性,B的水溶液显碱性。 ①C的化学式为________________。 ②反应的离子方程式为________________________________。
(4)若A为强碱,D为气态氧化物。常温时将B的水溶液露置于空气中,其pH随时间t变化可能如图a或图 b所示(不考虑D的溶解和水的挥发)。
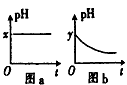
①若图a符合事实,则D为__________(填化学式),此图a中x______7(填“>”“<”或“=”)。
②若图b符合事实,则其pH变化的原因是___________________________(用离子方程式表示);已知图b中y<7,B的焰色反应为黄色,则B溶液中各离子的浓度由大到小的顺序是_____________________________________。
参考答案:(1)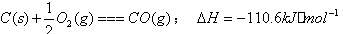
(2)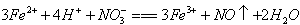
(3)①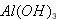 ;②
;②
(4)①CO②;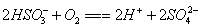 ;
;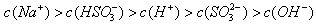
本题解析:
本题难度:一般