1、推断题 A、B、C,D、E、F六种强电解质在水中电离出的离子如下表所示,用洁净的铂丝分别蘸取B、D、F三种溶液在无色火焰上灼烧,火焰均呈黄色。
另有甲、乙、丙三种固体,分别是铝粉,铁粉和Al(OH)3固体中的一种,它们与A、B、C、D、E、F在常温下有如下转化关系:①固体乙+B溶液→F溶液+氢气 ②固体甲+C溶液→E溶液+氢气 ③过量C溶液+F溶液→D溶液+A溶液+水 请回答下列问题:
(1)M+的结构示意图为_______________________。
(2)写出下列物质的化学式:甲________________,B________________。
(3)写出反应③的离子方程式:_________________________________。
(4)常温下,A、B、C、D、E、F六种物质中,能促进水的电离且其水溶液pH<7的是____________(填化学式)。
(5)相同质量的A分别与题中涉及的某些物质反应均生成丙,其中生成丙的质量最大的反应的化学方程式为________________________________________。
参考答案:
(1)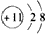
(2)Al;NaOH
(3)4H++AlO2-=Al3++2H2O
(4)Al2(SO4)3·FeSO4
(5)Al2(SO4)3+6NaAlO2+12H2O=8Al(OH)3↓+3Na2SO4
本题解析:
本题难度:一般
2、填空题 (5分)A、B、C、D、E五种物质均含有同一种元素,它们能发生如下图所示的变化。
写出五种物质的化学式:A______B_______C_______D_______E__________
参考答案:SiO2;CaSiO3;Na2SiO3;Si;H4SiO4(H2SiO3 )
本题解析:根据框图中的转化特点可判断,这是含硅元素之间的相互转化。因为在高温下既能和焦炭反应,又能和石灰石反应的一般是二氧化硅,即A是二氧化硅。
本题难度:一般
3、简答题 已知化合物A与B组成元素相同,在常温下均呈液态;D与E都为金属单质,且D、E与甲的浓溶液在常温作用都无明显现象,加热时有大量红棕色气体产生.E与D的氧化物的反应可用于焊接钢轨.
(1)A的结构式为______,说出A在医疗中的一种重要作用______.
(2)写出过量D与甲稀溶液反应的离子方程式:______;
(3)以D、E为电极,NaOH溶液为电解质溶液可以组成原电池,原电池负极的电极反应式为______.现利用此装置电解CuSO4溶液,电解一段时间后,阴阳两极产生的气体在标准状况下都是2.24L.请写出阳极的电极反应式______;若电解前CuSO4溶液的体积为200mL,则其物质的量浓度是______;
(4)含有D、E元素的一种新型无机高分子材料高效净水剂[ED(OH)4Cl2]m与过量浓盐酸溶液可以反应,其反应的化学方程式为______.
参考答案:化合物A与B组成元素相同,在常温下均呈液态,为H2O、H2O2;
D与E都为金属单质,E与D的氧化物的反应可用于焊接钢轨,为铝热反应,E为Al,D为Fe,Fe、Al与甲的浓溶液在常温作用都无明显现象,加热时有大量红棕色气体产生,甲为HNO3;
(1)A在医疗中有重要作用,可知A为H2O2,B为H2O,H2O2是共价化合物,分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,结构式为H-O-O-H,在医疗中常用于杀菌消毒;
故答案为:H-O-O-H,杀菌消毒;
(2)过量的Fe与稀硝酸反应生成硝酸亚铁、NO、水,反应离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(3)铝与氢氧化钠溶液反应,故铝为负极,Al放电,在碱性条件下生成偏铝酸根与水,
电极反应式为Al+4OH--3e-=AlO2-+2H2O;
电解CuSO4溶液,阳极是氢氧根离子放电,生成氧气与水,电解反应式为:4OH--4e-=O2↑+2H2O;
阴极产生的2.24L气体是氢气,在标准状况下氢气的物质的量为2.24L22.4L/mol=0.1mol,阳极产生的2.24L气体是氧气,在标准状况下氧气的物质的量为为2.24L22.4L/mol=0.1mol,令原溶液中Cu2+为amol,根据电子转移守恒有:2×amol+0.1mol×2=0.1mol×4,解得a=0.1,故CuSO4溶液的物质的量浓度为0.1mol0.2L=0.5mol/L;
故答案为:Al+4OH--3e-=AlO2-+2H2O,4OH--4e-=O2↑+2H2O,0.5mol/L;
(4)净水剂[AlFe(OH)4Cl2]m与过量浓盐酸溶液反应生成氯化铝、氯化铁与水,反应方程式为:[AlFe(OH)4Cl2]m+4mHCl=mAlCl3+mFeCl3+4mH2O;
故答案为:[AlFe(OH)4Cl2]m+4mHCl=mAlCl3+mFeCl3+4mH2O.
本题解析:
本题难度:一般
4、填空题 下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中常见的金属单质,J是黄绿色气态单质,M与氨水反应生成的O是白色沉淀。在B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
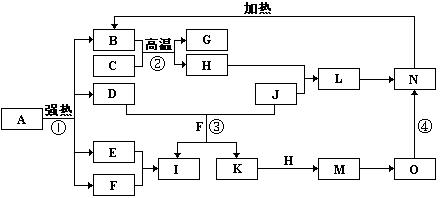
请按要求回答:
(1)H元素在周期表中的位置?。
(2)反应③的离子方程式?;
反应④的化学方程式 ? 。
(3)实验室用固体L配制溶液的方法是:
?。
(4)由L的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是?。若要提纯该胶体,采用的方法叫?。
参考答案:(1)第四周期、第Ⅷ族(2分)
(2)SO2+Cl2+2H2O=4H++SO +2Cl—(2分)
+2Cl—(2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(3)取FeCl3固体溶于浓盐酸,再加水稀释到所需的浓度(2分)
(4)1 nm~100 nm(1分)?渗析(1分)
本题解析:略
本题难度:一般
5、简答题 下面图表示制备无水盐E的主要步骤:
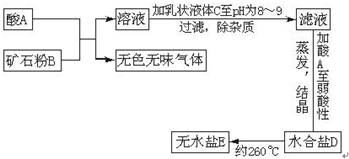
已知B是石灰石,D盐含有约49%的结晶水,无水盐E可用作干燥剂.取少量E溶于水,向其中滴加硝酸后,再滴加硝酸银溶液,有白色沉淀F生成.
填写以下空白(写出化学式或名称):
A______,C______,D______,E______,F______.
参考答案:这是一例典型的定性分析和定量分析相结合的推断题.
(一)定性分析:因为B是石灰石,和酸A反应,放出的无色无味气体应是CO2,生成可溶性钙盐,由此判定最终形成的无水盐E也是钙盐溶液,因为E溶于水后向其中滴加硝酸后,再滴加硝酸银溶液,有白色沉淀F生成,知F是AgCl,E是CaCl2,吻合了E可作干燥剂这条件,D是CaCl2的结晶水合物.
(二)定量分析:设无水盐为CaCl2?xH2O
? CaCl2?xH2O~xH2O
101+18x?18x ?
100?49
解之:x=6
则D盐化学式 CaCl2?6H2O酸A是盐酸,乳状液体C应是石灰乳,
故答案为:HCl(盐酸);Ca(OH)2(石灰乳);CaCl2?6H2O;CaCl2;AgCl.
本题解析:
本题难度:一般