1、填空题 在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH 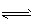 CH3COO-+H+ ; △H>0
CH3COO-+H+ ; △H>0
(1)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是____。
a.加入少量0. 10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0. 010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0. 10 mol·L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5。现有:
①0. 10 mol·L-1 CH3COOH溶液②0.001 0 mol·L-1 CH3COOH溶液
其c(H+)之比为①:②=____。[提示:进行简化计算,平衡时的 c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
(3)25℃时,向0.10 mol·L-1 CH3COOH溶液中加入一定量固体CH3 COONa (假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol·L-1,则溶液中 c( H+)=____mol·L-1(计算结果保留小数点后两位有效数字)。溶液中各种离子浓度关系是___。
2、选择题 下列叙述正确的是
A.电解质溶液中除阴、阳离子外,溶液中不会再有其他粒子
B.强电解质溶液的导电性一定强于弱电解质溶液
C.强电解质都是离子化合物,熔融状态下均能导电
D.电解质溶液中尽管阴、阳离子数目不一定相等,但阴离子带的负电荷总数与阳离子带的正电荷总数一定相等
3、选择题 下列说法正确的是
[? ]
A. 25℃时,0.1 mol/L pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 相同温度下,pH相等的Na2CO3溶液、C6H5ONa(苯酚钠)溶液、NaOH溶液:c(C6H5ONa)>c(Na2CO3)>
c(NaOH)
C. 常温下,将CH3COONa溶液、HCl溶液混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH)
D. 0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+
c(H2CO3)+2c(H+)
4、选择题 下列物质属于电解质的是( )
A.石墨
B.烧碱
C.蔗糖
D.金属铝
5、选择题 在0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是
[? ]
A.KBr
B.Mg(OH)2
C.Na2CO3
D.MgSO4