1、选择题 下列离子方程式书写正确的是:
A.碳酸氢钙溶液中加入过量的NaOH溶液: Ca2++HCO3―+OH―=CaCO3↓+H2O
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.FeI2溶液中通入少量Cl2:2 Fe2+ + Cl2="2" Fe3+ + 2Cl-
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全NH4++Al3++2Ba2++2SO42-+4OH- =Al(OH)3↓+NH3·H2O+2BaSO4↓
参考答案:D
本题解析:A、碱过量碳酸氢钙完全反应应满足化学式中离子浓度关系,故Ca2++2HCO3―+2OH―=CaCO3↓+CO32―+2H2O,错误;B、溶液为酸性时,完全反应Ba(OH)2,正确为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,错误;C、少量的氯气先氧化碘离子,错误;D、正确。
本题难度:一般
2、填空题 有一混合物的水溶液,只可能含有以下离子中的几种:K+、H+、Ba2+、Mg2+、CO32-、SO42-,现取两份该溶液各100ml进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol.
②第二份加入足量Ba(NO3)2溶液充分反应后过滤干燥,得沉淀4.66g.
根据上述实验回答:
(1)原溶液中一定不存在的离子是______.
(2)原溶液中可能存在的离子是______.
(3)①中发生反应的离子方程式为______.
(4)经计算,原溶液中一定存在的阴离子的物质的量浓度为______.
参考答案:(1)根据①现象知,该溶液中一定存在与碳酸氢根离子反应生成气体的H+,一定不存在与H+反应的碳酸根离子;所以溶液中存在的阴离子为硫酸根离子,一定不存在与硫酸根离子反应的Ba2+;
故答案为:CO32-、Ba2+;
(2)根据实验现象无法确定溶液中是否含有K+、Mg2+,故答案为:K+、Mg2+;
(3)碳酸氢根离子能和酸反应生成二氧化碳和水HCO3-+H+=CO2↑+H2O.
故答案为:HCO3-+H+=CO2↑+H2O;
(4)设硫酸根的物质的量为xmol. Ba2++SO42-=BaSO4 ↓
? 1 mol? 233g
? xmol?4.66g
x=0.02
所以C=nV=0.02mol?0.1L=0.2mol/L
故答案为:0.2mol/L.
本题解析:
本题难度:一般
3、选择题 下列表示对应化学反应的离子方程式不正确的是( )
A.FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
参考答案:A、FeCl3溶液与Cu的反应离子方程式为:Cu+2Fe3+=Cu2++2Fe2+;故A正确;
B、NO2与水的反应生成硝酸和一氧化氮,硝酸是强酸:3NO2+H2O=2NO3-+NO+2H+;故B正确;
C、醋酸酸性比碳酸强,可与碳酸钙反应,醋酸溶液与水垢中的CaCO3反应的离子方程式为:
CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-;故C错误;
D、过量的NaHSO4与Ba(OH)2溶液反应,氢氧化钡全部反应,离子方程式中符合化学式的组成比,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D正确;
故选C.
本题解析:
本题难度:简单
4、填空题 某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几
种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),回答下列问题:
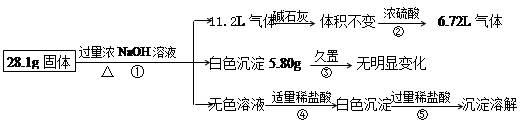
(1)混合物中是否存在FeCl2?___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4?___(填“是”或“否”),你的判断依据是?。
(3)写出反应④的离子反应式:?。
(4)请根据计算结果判断混合物中是否含有AlCl3_?_(填“是”或“否”),你的判断依据是?。
参考答案:⑴否?⑵是,气体通过浓硫酸减少4.48L。
(3)H++OH-=H2O? H2O+AlO2-+H+=Al(OH)3↓
(4)否,由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,而计算出三者质量之和刚好等于28.1g,所以原混合物中一定没有AlCl3。
本题解析:根据反应现象和化学计算判断物质的组成,根据加入氢氧化钠溶液得到白色沉淀,可推出无氯化亚铁;生成的气体通过碱石灰体积不变,而通过浓硫酸减少,说明气体中含有氨气,混合物中含有硫酸铵;③加入盐酸,先和①中过量的氢氧化钠反应,然后盐酸再与偏铝酸根反应,生成白色氢氧化铝沉淀;白色沉淀5.80g为氢氧化镁,可算出化合物中氯化镁的质量,气体通过浓硫酸减少4.48L,为氨气的体积,可求出硫酸铵的质量,剩余的6.72L气体为铝与氢氧化钠溶液反应生成的氢气,然后求出Al、(NH4)2SO4和MgCl2三者质量之和28.1g,正好等于原固体总质量,所以原混合物中一定不含AlCl3。
本题难度:一般
5、选择题 下列离子方程式正确的是( )
A.锌和稀硝酸的反应:Zn+2H+═Zn2++H2↑
B.氯气和水的反应:Cl2+H2O═2H++Cl-+ClO-
C.向硫酸铝溶液中滴加过量的氢氧化钡溶液2Al3++3SO42-+3Ba2++8OH-═2AlO2-+3BaSO4↓+4H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3-
参考答案:A.锌和稀硝酸的反应的离子反应为3Zn+8H++2NO3-═3Zn2++2NO↑+4H2O,故A错误;
B.氯气和水的反应的离子反应为Cl2+H2O═H++Cl-+HClO,故B错误;
C.向硫酸铝溶液中滴加过量的氢氧化钡溶液的离子反应为2Al3++3SO42-+3Ba2++8OH-═2AlO2-+3BaSO4↓+4H2O,故C正确;
D.向次氯酸钠溶液中通入足量SO2气体的离子反应为ClO-+SO2+H2O═2H++Cl-+SO42-,故D错误;
故选C.
本题解析:
本题难度:简单