1、选择题 ClO2遇浓盐酸会生成Cl2?,反应方程式为2ClO2?+?8HCl?=?5Cl2?+?4H2O?,该反应中若转移电子的数目为9.632×1023,则产生的Cl2在标况下的体积为
A.11.2L
B.33.6L
C.22.4L
D.44.8L
参考答案:C
本题解析:反应中转移电子的物质的量是9.632×1023÷6.02×1023/mol=1.6mol。根据反应的方程式可知,每生成5mol氯气,反应中就转移8mol电子,所以该反应中生成的氯气是1mol,标准状况下的体积是22.4L,答案选C。
本题难度:简单
2、选择题 家里的食用玉米油不小心混入了大量的水。要将玉米油与水分离,最简便的方法是
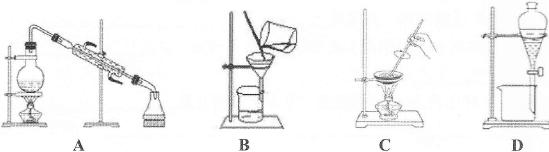
参考答案:D
本题解析:A、蒸馏可从混合溶液中分离出易挥发物质,错误;B、过滤可从液体中分离出难溶物,错误;C、蒸发可从溶液中分离出难挥发物质,错误;D、分液可将分层液体分离,正确。
本题难度:简单
3、选择题 高氯酸是最强的酸。60%的高氯酸溶液加热不分解,但浓度再高就不稳定,受热易分解。热浓的高氯酸遇有机物易爆炸。纯高氯酸的沸点是130℃。现在70%的商品高氯酸,为使其进一步浓缩,所采取的正确措施是
[? ]
A.加入浓H2SO4后,再小心常压蒸馏
B.加入浓H2SO4,再进行减压蒸馏
C.含仪器连接处的橡皮塞应塞紧,防止漏气
D.各仪器连接处必须用磨口玻璃装置
参考答案:BD
本题解析:
本题难度:一般
4、填空题 (12分)某钠盐溶液中可能含有阴离子:CO32-、SO32-、SO42-、Cl-、Br-、I-,为了鉴别这些离子,分别取少量溶液进行以下实验:
(1)加盐酸后,生成无色无味气体,该气体能使饱和石灰水变浑浊;
(2)加CCl4后,滴加少量氯水,震荡后CCl4层未变色;
(3)加BaCl2溶液后产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
(4)加稀HNO3酸化后,再加入过量AgNO3溶液,析出白色沉淀。
分析上述4个实验,写出每一步实验鉴定离子的结论与理由。
实验(1):??;
实验(2):?
?;
实验(3):??;
实验(4):??。
参考答案:(12分)每正确解答一个实验给3分
实验(1):肯定含有CO32-,肯定不含SO32-,因SO2有刺激性气味。
实验(2):肯定不含Br-、I-,因两者均能与氯水反应生成单质溴和单质碘,溴和碘单质均溶于CCl4显色。
实验(3):肯定含有SO42-,因BaSO4不溶于盐酸。
实验(4):肯定含有Cl-,因AgNO3与Cl-反应生成AgCl不溶于稀HNO3。
本题解析:(1)加盐酸后,生成无色无味气体,该气体能使饱和石灰水变浑浊,因此含有CO32-,而不含SO32-,因SO2有刺激性气味。
(2)震荡后CCl4层未变色,说明反应中没有生成单质碘或溴,因为如果含有,则因两者均能与氯水反应生成单质溴和单质碘,溴和碘单质均溶于CCl4显色。
(3)沉淀不能完全溶解,说明沉淀中一定含有硫酸钡沉淀,因为硫酸钡不溶于盐酸。
(4)加稀HNO3酸化后,再加入过量AgNO3溶液,析出白色沉淀,因此该沉淀是氯化银沉淀,因为AgNO3与Cl-反应生成AgCl不溶于稀HNO3。
本题难度:一般
5、选择题 下列实验装置、试剂选用或操作正确的是( )
A.
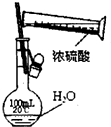
稀释浓硫酸
B.
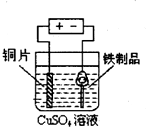
铁制品表面镀铜
C.
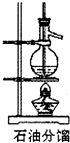
石油分馏
D.
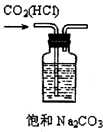
除去CO2中的HCl
参考答案:B
本题解析:
本题难度:简单