1、选择题 下列说法中,正确的是
①元素的原子都由质子、中子、电子构成
②具有相同核外电子数的微粒为同一种元素
③最外层电子数是2的原子,一定属于ⅡA族元素的原子
④固态离子化合物为离子晶体
⑤含有共价键的物质,固态时可能是分子晶体,也可能是原子晶体或离子晶体
⑥原子晶体的熔沸点比其他类型晶体的熔沸点都高
A.只有①②③
B.只有④⑤⑥
C.只有④⑤
D.只有⑥
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列晶体中,其中任何一个原子都被相邻四个原子包围,以共价键形成正四面体,并向空间伸展成网状结构的是
A.C60
B.冰
C.金刚石
D.水晶
参考答案:C
本题解析:向空间伸展成网状结构的必定是原子晶体。C60和冰都是分子晶体,不符合题意。在金刚石中,每个碳原子周围都有四个等距离的碳原子与之形成正四面体结构,所以C项正确。在水晶中,每个硅原子周围有四个氧原子以共价键与其相连形成正四面体结构,但是每个氧原子周围只有两个硅原子与之直接相连,因此D选项不符合题意。
本题难度:简单
3、选择题 只用一种试剂就能将BaCl2、NaCl、KOH三种无色溶液区别开,此试剂是
A.Na2CO3
B.盐酸
C.硫酸
D.Fe2(SO4)3溶液
参考答案:D
本题解析:分析:鉴别BaCl2,可用SO42-,鉴别KOH,可加入Fe3+,则应加入Fe2(SO4)3溶液即可鉴别.
解答:A.加入Na2CO3不能鉴别NaCl和KOH,故A错误;
B.加入盐酸,三种物质都没有明显现象,不能鉴别,故B错误;
C.硫酸加入不能鉴别NaCl和KOH,故C错误;
D.加入Fe2(SO4)3溶液,BaCl2生成白色沉淀,NaCl无现象,KOH生成红棕色沉淀,可鉴别,故D正确.
故选D.
点评:本题考查物质的鉴别,题目难度中等,本题注意根据物质的性质选择鉴别试剂,鉴别三种物质时,必须具有两种或两种以上的不同现象才能鉴别出来.
本题难度:一般
4、选择题 下列分子或离子的立体构型是平面三角形的是
①CH4? ②CH2O? ③CO2? ④SO3? ⑤BF3? ⑥H3O+? ⑦NH4+? ⑧P4
A.②④⑤
B.④⑤⑧
C.②③④⑤
D.②④⑤⑧
参考答案:A
本题解析:甲烷是正四面体结构,甲醛是平面三角形结构,CO2是直线型结构,三氧化硫是平面三角形结构,BF3是平面三角形结构,水合氢离子水三角锥形结构,铵根离子是正四面体形结构,白磷也是正四面体形结构,所以正确的答案选A。
本题难度:困难
5、选择题 如右图所示的是某原子晶体A空间结构中的一个单元,A与某物质B反应生成C,其实质是每个A—A键中插入一个B原子,则C物质的化学式为
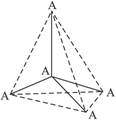
A.AB
B.A5B4
C.AB2
D.A2B5
参考答案:C
本题解析:据题意,中心A原子与周围4个A原子相连形成4个A—A键,而每两个A原子共用一个键,故A原子与A—A键的个数比为1∶2,又因为B原子与A—A键的个数相等,所以B∶A为2∶1。上面分析的是每个A原子占有多少个键,反过来,分析每个键占有多少个A原子也同样可以。当然,联想到这道题的晶体与SiO2晶体类型相同,就更容易理解了。
本题难度:困难