1、填空题 电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题:
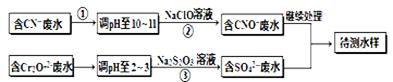
(1)上述处理废水流程中主要使用的方法是?。
(2)②中反应后无气体放出,该反应的离子方程式为?。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为?。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因?。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于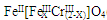 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是?。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是?。
A.x ="0.5" ,a =8
B.x ="0.5" ,a = 10
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
2、填空题 某同学设计了如下实验探究盐的水解反应规律.
(1)向碳酸钠溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:______
(2)用pH试纸测得硫酸铝溶液的pH为3,用离子方程式表示硫酸铝溶液呈酸性的原因:______;
(3)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:______.
3、选择题 【3分】能正确表示下列反应的离子方程式是(? )
A.碳酸氢铵溶液中加入NaOH溶液共热
B.用碳酸钠溶液吸收少量二氧化硫2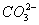 +SO2+H2O====2
+SO2+H2O====2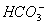 +
+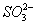
C.FeBr2溶液中加入过量的氯水2Fe2++2 Br-+2Cl2====Br2+4 Cl-+2Fe3+
D.硫酸镁溶液和氢氧化钡溶液反应 +Ba2+====BaSO4↓
+Ba2+====BaSO4↓
4、填空题 已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进 行下列实验,现象记录如下。
行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置 ?;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为?;
(3)实验④中的现象为:?;
(4)实验②反应的离子方程式是:?;
(5)实验③反应的离子方程式是:_?。
5、选择题 下列离子方程式中表达正确的是()
A.等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合时发生反应:
HCO3- + Ba2+ + OH- = BaCO3↓+ H2O
B.向AlCl3溶液中加入过量氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O
C.用铜作电极电解硫酸溶液:2H2O  2H2↑+O2↑
2H2↑+O2↑
D.硫酸亚铁溶液和稀硫酸、过氧化氢混合:Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O