1、简答题 A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六各物质中均含同一种元素.
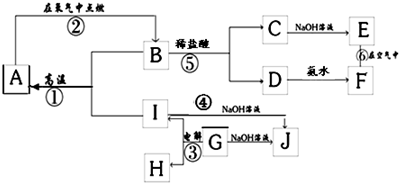
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在元素周期表中的位置是______.
(2)检验C溶液中阳离子的方法是(写出操作,现象及结论)______.
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:______;
反应④的离子方程式:______;
反应⑥的化学方程式:______;
(4)从能量变化的角度看,反应①②③中,属于△H<0的反应是______(填序号).
参考答案:G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,C、D分别和碱反应生成E、F,则说明E、F都为氢氧化物,E能转化为F,应为Fe(OH)2→Fe(OH)3的转化,所以E为Fe(OH)2,F为Fe(OH)3,则C为FeCl2,D为FeCl3,B为Fe3O4,与Al在高温条件下发生铝热反应生成A,即Fe,
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe元素,铁元素位于第四周期第Ⅷ族,故答案为:第4周期Ⅷ族;
(2)C是氯化亚铁,亚铁离子不稳定易被氧化生成铁离子,铁离子能和硫氰化钾溶液发生反应生成络合物而使其溶液呈血红色,所以检验亚铁离子的方法是:取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+,
故答案为:取少量溶液于试管中,滴加KSCN溶液,溶液无色,滴加氯水,溶液变为血红色证明C溶液中含Fe2+;
(3)高温下,铝和四氧化三铁反应生成氧化铝和铁,反应方程式为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe,
铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子反应方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:8Al+3Fe3O4?高温?.?4Al2O3+9Fe、2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)铝热反应和燃烧反应都是放热反应,故选①②.
本题解析:
本题难度:一般
2、填空题 根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。
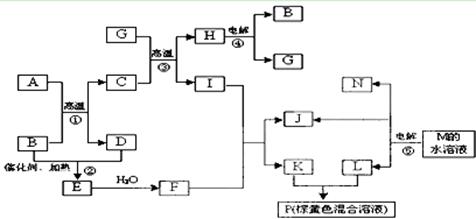
(1)I元素在元素周期表中的位置?;M中阴离子的结构示意图:?。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为??。
(3)写出下列化学反应的离子方程式:
①溶液P与KSCN溶液:_____________________________________?___;
②G与N的反应:______________________________________ ____ ______;
______;
③K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
?
参考答案:(1)第四周期第Ⅷ族;+19 2 8 8 。
(2)? FeS2
(3)写出下列化学反应的离子方程式:
①Fe3+ + 3SCN- = Fe(SCN)3
②2Al + 2OH- +2H2O ="=" 2AlO2- + 3H2
③2Fe2+ + Cl2 ="=" 2Fe3+ + 2Cl-
(4)4FeS2(S) + 11O2(g) ="=" 2Fe2O3(S) + 8SO2(g) ΔH =" -" 3408kl/mol
本题解析:略
本题难度:一般
3、填空题 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
(1)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是______.则C的化学式是______.配制C的溶液时可加入少量的______(填物质名称)以抑制水解.
②若A是某强酸的稀溶液,则A的化学式可能是______.
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为______.
(3)若B有两性
①若D是强酸,则能确定A、C中肯定含的离子的化学式分别是______、______.
②若D是强碱,则反应②的离子方程式是______.
(4)若A、B、C的焰色反应都呈黄色,D是气态酸性氧化物,则D可能是______或______(填化学式),鉴别它们常可选用______、______(任填两种试剂名称).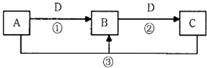
参考答案:(1)若D是生产、生活中用量最大、用途最广的金属单质判断为Fe;
①若A可用于自来水消毒,证明为Cl2,则用A制备漂白粉的化学方程式是氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
;C为FeCl2;配制FeCl2的溶液时可加入少量盐酸可以防止亚铁离子的水解,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;FeCl2 ;盐酸;
②若A是某强酸的稀溶液,实现上述转化必须要求酸是氧化性酸,判断为HNO3,故答案为:HNO3;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,判断A为碱性气体为NH3,B是汽车尾气之一,遇空气会变色,证明D为O2,反应①是氨气的催化氧化反应生成一氧化氮和水;化学方程式为:4NH3+5O2催化剂.△4NO+6H2O,故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(3)若B有两性可能是两性氧化物或两性氢氧化物;
①若D是强酸,B为两性 氢氧化物为Al(OH)3,则能确定A、C中肯定含的离子的化学式分别是:AlO2-、Al3+,故答案为:AlO2-;Al3+;
②若D是强碱,B为两性氢氧化物为Al(OH)3,A为Al3+反应②是氢氧化铝和强碱反应,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)若A、B、C的焰色反应都呈黄色,证明含有钠元素,D是气态酸性氧化物实现上述变化,D可以是CO2,SO2,依据性质鉴别可以用高锰酸钾溶液,品红试液,
故答案为:品红溶液;溴水或高锰酸钾溶液;
本题解析:
本题难度:简单
4、填空题 (10分)中学化学中有很多物质可以实现下图中物质之间的转化,其中反应条件和部分反应的产物已略去,液体B和C可能是单一溶质的溶液,也可能是纯净物。
(1)若A是一种紫红色金属,气体D能使品红溶液褪色,加热时又恢复原色。写出A与B反应的化学方程式?。
(2)若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色,则A与B溶液反应的离子方程式?,
写出红棕色气体与水反应的化学方程式?。
(3)若A是黑色固体单质,D是两种气体的混合物,其中有一种气体能使澄清石灰水变浑浊,则A与B溶液反应的化学方程式为?。
(4)如果气体D和溶液B都能便湿润的红色石蕊试纸变蓝,则该反应的离子方程式为?。
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。(2分)
CuSO4+SO2↑+2H2O。(2分)
(2)3Cu+8H++2NO3— ===3Cu2++2NO↑+4H2O。(2分)? 3NO2+H2O===2HNO3+NO
(3)C+4HNO3(浓)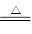 CO2↑+4NO2↑+2H2O。(2分)
CO2↑+4NO2↑+2H2O。(2分)
(4)NH4++OH—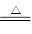 NH3↑+H2O(2分)
NH3↑+H2O(2分)
本题解析:(1)A是一种紫红色金属,则A是铜,D是SO2,所以是铜和浓硫酸的反应。
(2)D是一种无色气体,遇到空气变为红棕色,则D是NO,NO不稳定极易被氧气氧化生成NO2。液体C呈蓝色,说明含有铜离子,因此是铜稀硝酸的反应。
(3)能使澄清石灰水变浑浊的气体一般是CO2或SO2。又因为A是黑色固体单质,所以A是碳,气体是CO2。因此是碳和浓硝酸的反应。
(4)能便湿润的红色石蕊试纸变蓝的一定显碱性,所以D是氨气,B是强碱,和铵盐反应生成氨气。
本题难度:一般
5、推断题 现有金属单质A.B.C和气体甲、乙、丙及物质D.E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
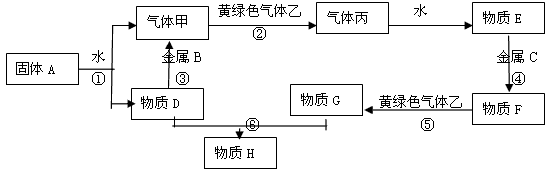
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A? ?、 B? 、 C? ?、 F? 、 H? 、 乙? ?
(2)写出下列反应化学方程式:
反应①? ?
反应⑤? ? ?
反应⑥? ?
参考答案:(1)A:Na? B:Al? C:Fe? F:FeCl2? H:Fe(OH)3? 乙:Cl2
(2)反应①:2Na + 2H2O == 2NaOH + H2↑
反应⑤:2FeCl2 + Cl2 == 2FeCl3
反应⑥:FeCl3+ 3NaOH == Fe(OH)3↓+ 3NaCl
本题解析:
本题难度:一般