1、填空题 (12分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3 7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是 (填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为 。
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3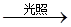 O+O2
O+O2
Ⅱ、NO+O3 →NO2+O2
Ⅲ、 NO2+O→NO+O2
上述反应中NO所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ
| 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4
|
方法Ⅱ
| 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫
|
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,写出该反应的离子方程式: ,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
参考答案:(1)防止酸雨的发生(2分 其他合理答案同样给分)
(2)①N(2分) 0.7mol(2分) ② 催化剂(2分) (3)SO2+NH3·H2O=NH4HSO3; D(2分)
本题解析:(1)烟气脱硫、脱硝可以防止酸雨的发生,故答案为:防止酸雨的发生;
(2)①反应中氨气中的N元素由-3价升高为0价,失去电子被还原,由反应可知,转移24mol电子,生成7mol氮气,则反应中每转移2.4mol电子,生成N2的物质的量为0.7mol,故答案为:N;0.7mol;
②将三个反应加和得到总反应为2O3=3O2,则反应中NO所起的作用是催化剂,故答案为:催化剂;
(3)①氨水吸收燃煤烟气中的SO2转化为NH4HSO3,为酸性氧化物与碱的反应,则体现SO2的酸性氧化物性质,方程式为SO2+NH3·H2O=NH4HSO3,故答案为:SO2+NH3·H2O=NH4HSO3;D。
考点:考查氧化还原反应的应用、大气污染治理等
本题难度:一般
2、选择题 已知反应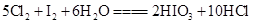 ,
,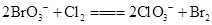 ,下列物质氧化性强弱顺序正确的是(?)
,下列物质氧化性强弱顺序正确的是(?)
A.
B.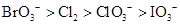
C.
D.
参考答案:C
本题解析:根据氧化还原反应的规律,氧化性的比较顺序为:氧化剂>氧化产物>还原产物>还原剂。则可以找到氧化性的比较:BrO3-> ClO3->Cl2> ClO3->I2
点评:本题属于常见题型,涉及到了氧化性强弱的比较,只要抓住氧化性比较顺序的规律就可以得到正确答案。
本题难度:简单
3、选择题 已知Co2O3在酸性溶液中易被还原成Co2+、Co2O3、Cl2、FeCl3、I2的氧化性依次减弱,下列反应在水溶液中不可能的是
[? ]
A、3Cl2 + 6FeI2 = 2FeCl3 + 4FeI3
B、Cl2 + FeI2 = FeCl2 + I2
C、Co2O3 +6HCl = 2CoCl2 + Cl2↑ + 3H2O
D、2Fe3+ + 2I- = 2Fe2+ + I2
参考答案:A
本题解析:
本题难度:一般
4、计算题 有NH4+、Fe3+、NO3-、Fe2+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物。
(1).氧化剂与还原剂的物质的量之比为
(2).若有l mol NO3-参加反应,则转移 mol e-
(3).若把该反应设计为原电池,则负极反应为
参考答案:(6分)
(1)1:8 (2)8 (3)Fe2+ - e-= Fe3+
本题解析:略
本题难度:一般
5、选择题 根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
[? ]
A.X > Z > Y > W
B.Z > W > X > Y
C.Z > Y > X > W
D.Z > X > Y > W
参考答案:D
本题解析:
本题难度:一般