1、选择题 吸热反应一定是(? )。
A.释放能量
B.反应物总能量高于生成物总能量
C.贮存能量
D.反应物总能量低于生成物总能量
参考答案:CD
本题解析:反应物总能量低于生成物总能量时,才能发生吸热反应,将贮存能量。
本题难度:简单
2、选择题 下列说法或表示方法正确的是
A.由石墨比金刚石稳定可知:C(金刚石, s) = C(石墨, s) ΔH﹤0
B.强酸跟强碱反应放出的热量就是中和热
C.反应物的总能量低于生成物的总能量时,该反应一定不能发生
D.在101KPa、25℃时,1gH2完全燃烧生成气态水,放出120.9kJ热量,则氢气的燃烧热为241.8 kJ/mol
参考答案:A
本题解析:石墨比金刚石稳定,说明石墨的总能量小于金刚石的总能量,因此金刚石转化为石墨是放热反应,△H<0,选项A正确;中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以选项B不正确;反应条件与反应是放热反应或吸热反应无关系,选项C不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的温度状态是液态,选项D不正确,答案选A。
本题难度:一般
3、选择题 下列变化过程中,是吸热反应的是
A.H+H→H2
B.H+Cl→HCl
C.I2→I+I
D.S+O2→SO2
参考答案:C
本题解析:断开化学键需要吸热,而硫的燃烧是放热反应。
本题难度:简单
4、简答题 化学反应与能量有比不可分的关系,回答下列问题.
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于______(填“物理”或“化学”)变化.
(2)31g白磷具有的能量_______(“>”或“<”)31g红磷具有的能量,常温常压下,______更稳定.
(3)31g白磷完全燃烧释放的能量_______(“>”或“<”)31g红磷完全燃烧释放的能量.
Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸

(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A______;B______;C______.
(2)一段时间后,B中Sn极附近溶液的pH______(填“增大”、“减小”、“不变”).
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=______mol?L-1.此时,三个烧杯中液体质量由大到小的顺序为:______(填写序号).
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______(填写序号).
Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
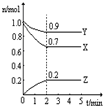
(1)该反应的化学方程式为______.
(2)反应开始至2min,以气体Z表示的平均反应速率为______.
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的______倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时______(填“增大”“减小”或“相等”).
参考答案:Ⅰ:(1)因白磷和红磷是不同的物质,白磷变为红磷是化学变化,故答案为:化学;
(2)因白磷变为红磷释放能量,所以白磷具有的能量大于红磷具有的能量,物质的能量越低,稳定性越好,故答案为:>;红磷,
(3)因化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量大,生成物的能量相同,放出的能量也大,故答案为:>,
Ⅱ:(1)A中是金属铁和硫酸能发生置换反应,原理方程式为:Fe+2H+=Fe2++H2↑;B中Sn、Fe、硫酸构成的原电池,金属铁较活泼,做负极,电极反应为:Fe-2e-=Fe2+,C中Zn、Fe、硫酸构成的原电池,金属锌较活泼,做负极,金属铁作正极,该极发生的电极反应为:2H++2e-=H2↑,故答案为:Fe+2H+=Fe2++H2↑;Fe-2e-=Fe2+;2H++2e-=H2↑;
(2)B中Sn(锡)极发生的电极反应为:2H++2e-=H2↑,所以氢离子浓度减小,酸性减弱,pH增大,故答案为:增大;
(3)电池总反应为:H2SO4+Fe=FeSO4+H2↑,n(H2SO4)=n(H2)=3.36L?22.4L/mol?=0.15mol,
? 则:c(H2SO4)=0.15mol0.2L?=0.75mol/L,
? A中是金属铁和硫酸能发生置换反应,进入的是铁,出去的是氢气,质量增重是54,B中Sn、Fe、硫酸构成的原电池,进入的是铁,出去的是氢气,质量增重是54,C中Zn、Fe、硫酸构成的原电池,进入的是锌,出去的是氢气,质量增重是63,原来三个溶液的质量相等,而溶液质量的变化等于进入和出去的物质的质量之差,所以三个烧杯中液体质量由大到小的顺序为:C>A=B,
故答案为:0.75;C>A=B;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,腐蚀速率最小,故答案为:BAC.
Ⅲ.(1)由图象可知,在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,同时该反应为可逆反应,相同时间内物质的量的变化比值为:c(X):c(Y):c(Z)=(1.0-0.9):(1.0-0.7):0.2=1:3:2,化学反应中物质的量变化之比等于化学剂量数之比,则化学方程式为Y+3X?2Z,故答案为:Y+3X?2Z;
(2)反应开始至2min,气体Z的平均反应速率v=△c?△t?=0.2mol?2L?2min=0.05mol/(L.min),故答案为:0.05mol/(L.min);
(3)①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,在相同温度下,气体的物质的量之比等于压强之比,反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10,故答案为:9:10,
? ?②根据物质的摩尔质量M=mn,反应前后气体的质量不变,物质的量减少,所以混合气体的摩尔质量增大,而容器内混合气体的平均相对分子质量在数值上等于摩尔质量,所以平均相对分子质量也增大,故答案为:增大.
本题解析:
本题难度:一般
5、选择题 从如图所示的某气体反应的能量变化分析,以下判断错误的是 ( )
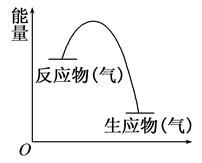
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
参考答案:D
本题解析:反应是放热反应还是吸热反应,与反应条件无关系,只与反应物和生成物总能量的相对大小有关系。根据图像可知,反应物的总能量高于生成物的总能量,所以该反应是放热反应,选项ABC是正确的。D不正确,能量越低越稳定,所以生成物比反应物更稳定,答案选D。
点评:该题是基础性试题的考查,主要是考查学生对反应热含义以及大小影响的熟悉了解程度,旨在巩固学生的基础,提高学生的能力。
本题难度:简单