1、填空题 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?。
(2)下列说法错误的是?。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物?(高或低),原因是?。
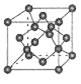
(4)B单质的一种同素异形体的晶胞如图甲所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为?cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
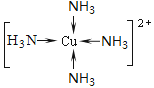
① F原子的外围电子排布式为________。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为?。
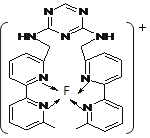
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图乙所示的离子:该离子中碳原子的杂化方式有?。
 ?
?
图甲?图乙
参考答案:(1)C<O<N(2分)
(2)ACD(2分)
(3)低(1分)?Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小(2分)
(4)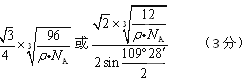 ?
?
(5)①3d104s1 (1分)?(2分)?
②sp2、sp3(2分)
本题解析:B元素含有3个能级1s、2s、2p,且每个能级所含的电子数相同,都是2个电子,则B为C元素;D的原子核外有8个运动状态不同的电子,所以D是O元素;则C是N元素;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,说明E、F是第四周期元素,因为前三周期相邻主族元素的原子序数只差1,E元素的基态原子有4个未成对电子,则E为26号元素Fe,F为29号元素Cu。
(1)同周期元素第一电离能随核电荷数增大而升高,但N的2p轨道电子是半充满,比较稳定,不易失去,所以C、N、O三种元素的第一电离能由低到高的顺序是C<O<N;
(2)A、二氧化硅是原子晶体,二氧化碳是分子晶体,所以沸点:SiO2>CO2,A错误;B、同周期元素随核电荷数增大而增强,正确;C、N2与CO为等电子体,具有相似的化学结构,错误;D、氢键与熔沸点高低有关,因为O的原子半径小于S的原子半径,所以H2O分子中共价键比H2S强,所以水更稳定,错误,答案选ACD;
(3)FeO的沸点比Fe2O3低,是因为Fe2+半径比Fe3+大,所带电荷也小于Fe3+,FeO的晶格能比Fe2O3的小的缘故;
(4)该晶胞中有8×1/8+6×1/2+4=8个C原子,设晶胞的棱长是acm,则ρ="8×12" NA/a3, 晶体中最近的两个原子是以面对角线一半的两端的C原子构成的正四面体中心与顶点的距离,利用数学知识课求解,答案为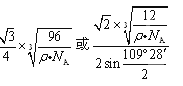 。
。
(5)①F为29号Cu,外围电子的排布式为3d104s1,N为氨气,向硫酸铜溶液中通入过量氨气,生成四氨合铜络离子,其结构式为

②C与N(或C)以不饱和键结合时是sp2杂化,以饱和键结合时为sp3杂化。
本题难度:困难
2、选择题 下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.1和17
B.12和9
C.14和6
D.15和8
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列含有同一元素的含氧酸中酸性强弱比较正确的是( )?
A.H2SO3>H2SO4?
B.HNO3>HNO2?
C.H3PO3>HPO3?
D.HClO>HClO4
参考答案:BC?
本题解析:同种元素的不同价态的无机含氧酸,价态越高,酸性越强。?
本题难度:简单
4、选择题 下列物质分子的电子式正确的是
[? ]
A.CH3Cl 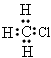
B.羟基 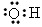
C.CO2 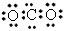
D.C2H4 
参考答案:D
本题解析:
本题难度:简单
5、填空题 (12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式?;
(2)B、C、D三种元素电负性由大到小的顺序是?(用元素符号表示);
(3)下列有关上述元素的说法,正确的是?(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为?,1 mol B2A4分子中含有?molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是?。
说明:O摄氏度=273K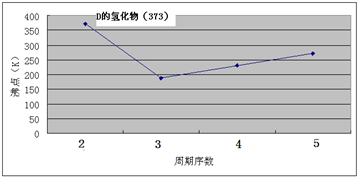
参考答案:(1)1S22S22P63S23P1?(2)O > N > C
(3)④⑤?(4)三角锥形,? 5
(5)MgO晶体中离子的电荷数大于NaCl,离子间的平均距离小于NaCl,离子键的键能更大,熔点更高
本题解析:原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个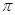 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
本题难度:一般