1、选择题 在短周期元素中,原子最外电子层只有1个或2个电子的元素是(?)
A.金属元素
B.非金属元素
C.稀有气体元素
D.无法确定为哪一类元素
参考答案:D
本题解析:在短周期元素中,原子最外电子层只有1个或2个电子的元素可以是第IA或第ⅡA,也可能是0族的He,所以正确的答案是D。
本题难度:一般
2、选择题 下列说法正确的是
A.酸只有一种分类方法,可分为含氧酸和无氧酸
B.碱只有两种分类方法,可分为强碱和弱碱,也可分为一元碱、二元碱等
C.氧化物不可进一步分类
D.树状分类法和交叉分类法都是常用分类方法
参考答案:D
本题解析:分类的标准和方法不同,得到的结论也不相同,对物质和化学反应也是这样,每一类物质一般都有许多分类方法,A、B、C选项都是错误的,D选项正确.
本题难度:简单
3、填空题 下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:
族 周期? 周期?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| 0
|
1
| IA
| ⅡA
| IIIA
| IVA
| VA
| VIA
| VIIA
| ?
|
2
| ?
| ?
| ?
| ?
| ③
| ④
| ?
| ?
|
3
| ⑤
| ⑥
| ⑦
| ⑧
| ?
| ⑨
| ⑩
| ?
|
⑴⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
⑵比较④⑨的氢化物沸点高低顺序并说明理由____________________________。
⑶ lg单质①在常温下完全燃烧生成气态产物放出Q kJ的热量,请写出其表示燃烧的热化学方程式_________________________________________。
⑷由表中两种元素组成的电子数与⑨相同的化合物的化学式为________________。
⑸由⑦⑩两种元素组成的一种化合物,其水溶液呈_________性(填“酸”、“碱”或“中”),其原因_____________________(用离子方程式表达)。
⑹由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式__________________________________。
参考答案:(1)S2->Cl->Na+>Mg2+ ?
(2)H2O的沸点高于H2S,原因是液态水分子间存在氢键
(3)H2(g)+1/2 O2(g)=H2O(g)?△H=" -2QkJ/mol"
或者2H2(g)+ O2(g)=2H2O(g)?△H=" -" 4QkJ/mol
(4)C2H4
(5)酸? Al3++3H2O? = Al(OH)3+3H+
(6)3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+
本题解析:由图可得①号元素为H,②③④分别为C、N、O,⑤⑥⑦⑧⑨⑩分别为Na、Mg、Al、Si、S、Cl。(1)⑤⑥⑨⑩对应的离子分别为:Mg2+ 、Na+、S2-、Cl-,由具有相同核外电子层分布的离子,原子的序数越低其半径越大,所以半径:Na+>Mg2+,同理可得半径:S2->Cl-。又因为Na+、Mg2+的核外电子层数是2,而S2-、Cl-的核外电子层数是3,故⑤⑥⑨⑩的离子半径由大到小的顺序为S2->Cl->Na+>Mg2+ ?
(2)④是O,⑨是S,二者对应的氢化物分别为H2O和H2S,由于液态水分子间存在氢键,所以H2O的沸点高于H2S。(3)①号元素为H, H2燃烧生成气态的水,lgH2在常温下完全燃烧生成气态产物放出Q kJ的热量,则1molH2的燃烧放出的热量为2Q,故表示H2燃烧的热化学方程式为:H2(g)+1/2 O2(g)=H2O(g)?△H=" -2QkJ/mol" 。(4)⑨号元素是S,其电子数是16,由表中两种元素组成的电子数与⑨相同的化合物是
C2H4。(5)由⑦⑩两种元素组成的化合物是AlCl3,AlCl3在水中发生水解,所以其水溶液呈酸性,原因是: Al3++3H2O? = Al(OH)3+3H+(6)④是O,⑤是Na,它们组成的化合物是: Na2O和Na2O2,由题意可知Fe2+被氧化,所以题中所说的化合物是Na2O2,发生反应的离子方程式为:3Na2O2+6Fe2++6H2O=6Na++4Fe(OH)3↓+2Fe3+
点评:本题从短周期元素出发,考察了与它们相关的知识点,较为综合。但前5题难度不大,学生凭基础知识即可解决,最后一题难度有点大,需要学生将过氧化钠和过氧化氢联系起来,同时应用氧化还原的相关知识来解题。
本题难度:一般
4、选择题 随核电荷数的增大,卤素单质性质的递变规律正确的是
A.密度逐渐减小,颜色逐渐加深
B.氧化性逐渐加强
C.还原性逐渐减弱
D.与氢化合条件逐渐困难
参考答案:D
本题解析:随核电荷数的增大,卤素单质氧化性逐渐减弱,与氢气的化合越来越难,选项BC不正确,D正确;密度逐渐增大,颜色逐渐加深,A不正确,答案选D。
点评:该题是常识性知识的考查,属于识记性知识的检验。难度不大,关键是熟练记住变化规律,并能灵活运用即可。
本题难度:一般
5、填空题 (5分)A、B、C、D、E是周期表中五种常见的短周期元素,原子序数依次增大。C、D、E最高价氧化物对应的水化物两两均可以相互反应生成盐和水;A的原子序数与C的最外层电子数相同:B的氢化物水溶液显碱性;E的氢化物水溶液为强酸。回答下列问题:
(1) D在周期表中的位置是__________,写出D的氧化物与强酸反应的离子方程式:____________________
(2) B的氢化物呈碱性的原因: ______________________ ________(用方程式表示)
________(用方程式表示)
(3) 用电子式来表示化合物CE的形成过程: _____________________________ _
_
(4) E的单质与 A的一种氧化物反应生成具有漂白性的物质。有关反应的化学方程式为: ________________________________________
A的一种氧化物反应生成具有漂白性的物质。有关反应的化学方程式为: ________________________________________
参考答案:
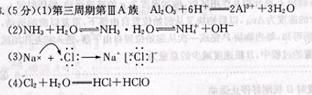
本题解析:略
本题难度:一般