1、选择题 在d轨道中电子排布成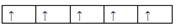 ,而不排成
,而不排成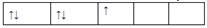 最直接的根据是? (? )
最直接的根据是? (? )
A.能量最低原理
B.泡利不相容原理
C.洪特规则的特例
D.洪特规则
参考答案:D
本题解析:洪特规则是在同一亚层中的电子尽可能分占不同轨道,而且自旋方向相同。
本题难度:一般
2、选择题 价电子排布式为2s22p5的原子,下列有关它的描述正确的是(?)
A.原子序数为7
B.第一电离能最大
C.原子半径最大
D.电负性最大
参考答案:D
本题解析:外围电子排布式为2s22p5的元素,是F元素.
A、F元素的原子序数为9,故A错误;
B、同周期自左而右第一电离能增大,F元素的第一电离能不是最小的元素,第一电离最小的元素处于周期表的左下角,故B错误;
C、原子半径最小的是H原子,故C错误;
D、同周期自左而右电负性增大,同主族自上而下电负性降低,电负性最大的元素处于周期表的右上角,故F元素是电负性最强的元素,故D正确。
故选D。
点评:考查核外电子排布规律、同周期同主族元素性质的递变规律等,难度不大,注意基础知识的掌握。
本题难度:简单
3、选择题 2011年3月,日本因发生9.0级特大地震而导致核电站的放射性物质严重泄漏。放射性物质主要包括13153I和13755Cs,13153I可能会引发甲状腺疾病,13755Cs则会造成人体造血系统和神经系统损伤。下列关于13153I和13755Cs的说法错误的是(?)
A.12753I、13153I、 13455Cs、13755Cs是四种核素,两组同位素
B.Cs+半径大于I-半径
C. 13153I和13755Cs的中子数分别是78、82
D.铯与碘化合生成的CsI属于离子化合物
参考答案:B
本题解析:根据原子序数,得出,Cs在I的下一个周期,则Cs+与I-具有相同的核外电子排布,核电荷数越大,微粒半径越小,所以Cs+半径小于I-半径。铯是活泼金属,
碘是活泼非金属,所以形成的是离子化合物。
本题难度:一般
4、选择题 短周期非金属元素X和Y能形成XY2型化合物,下列有关说法正确的是
A.XY2一定能与水反应
B.XY2水溶液不可能呈碱性
C.符合要求的XY2物质的两种
D.X、Y一定不是同一主族的元素
参考答案:B
本题解析:略
本题难度:简单
5、选择题 1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一种是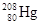 ,它的中子数为:
,它的中子数为:
A.80
B.288
C.208
D.128
参考答案:D
本题解析: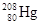 表示质子数为80,质量数为208的原子。它的中子数为208-80=128.因此选项为D。
表示质子数为80,质量数为208的原子。它的中子数为208-80=128.因此选项为D。
本题难度:简单