1、选择题 设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
A.在标准状况下,22.4LHF中含有的分子数为NA
B.在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA
C.常温常压下,足量的Fe在1molCl2中充分燃烧,转移的电子数为2NA
D.106gNa2CO3固体中的阴离子数大于NA
参考答案:A、N=nNA=VVmNA=22.4L22.4L/mol×NA=NA,故A正确.
B、标准状况下11.2LNO和11.2LO2混合后反应生成11.2LNO2,剩余5.6L氧气,所以气体分子数为0.75NA;但是,NO2能发生可逆反应转变为N2O4,所以最后的气体分子数小于0.75NA,故B错误.
?C、铁在氯气中燃烧的反应是2Fe+3Cl2=2FeCl3,1mol氯气转移的电子数为2NA,故C错误.
D、106g碳酸钠为1mol,106gNa2CO3固体中,n(Na2CO3)=n(CO32- )=1mol,N(CO32- )=nNA=NA,
故D错误.
故选A.
本题解析:
本题难度:一般
2、选择题 设NA代表阿伏伽德罗常数,下列说法正确的是( )
A.1?mol?MgCl2中含有的离子数为2NA
B.标准状况下,11.2?L?H2O中含有的原子数为1.5NA
C.0.5?mol/LFe2(SO4)3溶液中,SO
的数目为1.5NA
D.常温下,2.7?g铝与足量的盐酸反应,失去的电子数为0.3NA
参考答案:A、氯化镁是强电解质溶液中全部电离,1 mol MgCl2中含有的离子数为3NA,故A错误;
B、标准状况,水不是气体,11.2 L H2O物质的量不是0.5mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、常温下,2.7 g铝与足量的盐酸反应,失去的电子数为0.3NA,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 用NA代表阿伏加德罗常数,下列说法正确的是
[? ]
A.1?mol?Na与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.0.1mol/L?Na2S溶液中,S2-的数目一定小于0.1?NA?
C.常温常压下,0.2?mol?SiO2晶体中所含分子数为0.2?NA
D.密度为ρ?g/L的某气体纯净物一个分子的质量为?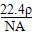 ?g?
?g?
参考答案:A
本题解析:
本题难度:简单
4、选择题 设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.10g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA
B.1molC10H22分子中含有的共价键数目为32NA
C.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中氢离子数目为NA
D.标准状况下,22.4LCH4和CH3OH的混合物中含有NA个碳原子
参考答案:A、10g质量分数为46%的乙醇溶液中含溶质乙醇质量=10g×46%=4.6g;含溶剂水质量=10g×(1-46%)=5.4g;所含氢原子物质的量=4.6g46g/mol×6+5.4g18g/mol×2=1.2mol,故A正确;
B、1molC10H22分子中含有的共价键数目=1mol×(22+10-1)=31mol,故B错误;
C、含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,醋酸电离出的氢离子和水电离出的离子目大于NA,故C错误;
D、标准状况下,甲醇是液体,所以22.4LCH4和CH3OH的混合物的物质的量不一定是1mol,故D错误;
故选A.
本题解析:
本题难度:简单
5、选择题 NA代表阿伏加德罗常数的数值.下列有关NA的叙述中,正确的是
A.1?mol任何物质所含的分子数均为NA个
B.14?g氮气所含的N原子数为NA个
C.标准状况下,22.4?L水所含的H2O分子数为NA个
D.在钠与氯气的反应中,1?mol钠失去电子的数目为2?NA个
参考答案:B
本题解析:分析:A、物质的量描述的是微观粒子;
B、14g氮气的物质的量是0.5mol,含有1mol氮原子;
C、标况下,水不是气体,无法计算水的物质的量;
D、根据电子守恒进行判断,1mol失去1mol电子.
解答:A、应该是1 mol任何微粒所含的分子数均为NA个,故A错误;
B、14 g氮气所含的N原子的物质的量是0.5mol,所含的N原子数为NA个,故B正确;
C、标准状况下,水是液体,无法计算水的物质的量,故C错误;
D、在钠与氯气的反应中,1 mol钠失去1mol电子,电子的数目为NA个,故D错误;
故选B.
点评:本题考查阿伏伽德罗常数,注意标准状况下物质的状态,本题难度中等.
本题难度:困难