1、简答题 甲、乙、丙三位同学分别用如图所示三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
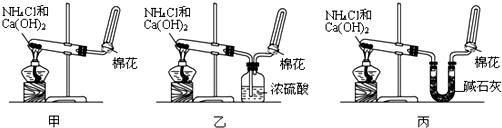
(1)三位同学制取氨气的化学方程式为:______.
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作都正确),你认为没有收集到氨气的同学是______(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是______(用化学方程式表示).
(3)检验氨气是否收集满的方法是______
A、闻到有氨气逸出
B、棉花被气体冲出
C、用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D、用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(4)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的是______(填“甲”、“乙”或“丙”).
2、实验题 高纯氧化铁(α-Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如下
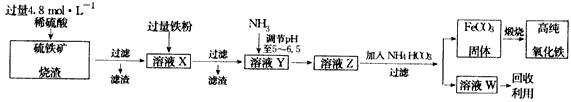
试回答下列问题:
(1)实验室用18.4 mol/L的浓硫酸配制250 mL 4.8 mol/L的硫酸溶液,所用的玻璃仪器除胶头滴管、量筒、烧杯、玻璃棒和酸式滴定管外,还需(填写仪器名称)_____________;
(2)溶液X中加入铁粉后可能发生反应的离子方程式为______________________
(3)某同学选用下列装置来制备纯净干燥的氨气,请完成下列有关问题
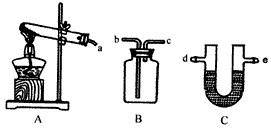
①装置A中可以选用下列试剂中的__________(填写序号字母);
a.(NH4)2SO4和生石灰 b.NH4Cl和Ca(OH)2固体 c.NH4HCO3固体 d.NH4Cl固体
②装置C中试剂最好是__________(填写试剂名称);
③收集NH3时,气体应由__________(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式:____________________。
3、选择题 下列各组物质在一定条件下充分反应后,生成气体的物质的量肯定等于或大于1mol的是
A.400mL10mol/L的浓盐酸与足量MnO2反应
B.1molCu与200g98%的浓硫酸反应
C.65gZn与足量的硝酸反应
D.2molH2O(g)和CO2的混合气体与足量的Na2O2充分反应
4、填空题 某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置.
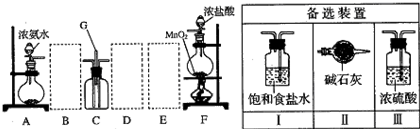
请回答下列问题:
(1)装置F中发生反应的离子方程式是______.
(2)装置A中的烧瓶内固体可选用______(选填以下选项的代号).
A.碱石灰?B.浓硫酸?C.生石灰?D.五氧化二磷?E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格.B______、D______、E______.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:______;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:______.
(5)若从装置C和G处逸出的尾气中含有N2和少量Cl2,应如何处理?______.
5、实验题 高纯氧化铁(α-Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分是Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如下:
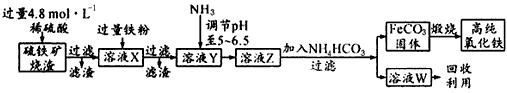
请回答下列问题:
(1)实验室用18.4 mol/L的浓硫酸配制250 mL 4 8 mol/L的硫酸溶液,所用的玻璃仪器除胶头滴管、量筒、烧杯、玻璃棒和酸式滴定管外,还需_________(填写仪器名称)。
(2)溶液X中加入铁粉后可能发生反应的离子方程式为______________________
(3)某同学选用下列装置来制备纯净干燥的氨气,请完成下列有关问题:
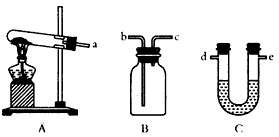
①装置A中可以选用下列试剂中的___________(填写序号字母);
a.(NH4)2SO4和生石灰 b.NH4Cl和Ca(OH)2固体 c.NH4HCO3固体 d.NH4Cl固体
②装置C中试剂最好选用_________(填写试剂名称);
③收集NH3时,气体应由_________(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式__________________