1、选择题 下列各离子方程式正确的是( )
A铁片投入稀硫酸中:2Fe + 6H ="===" 2Fe
="===" 2Fe + 3H2↑
+ 3H2↑
B用石灰石与盐酸反应制取CO:CO32-+ 2H+="===" H2O + CO2↑
C Ba (OH)2溶液中加入稀硫酸:Ba2++ SO42-="===" BaSO4 ?
?
D金属钠与水反应:2Na +2 H2O ="===" 2Na + 2OH
+ 2OH + H2↑
+ H2↑
参考答案:D
本题解析:A错,正确为:Fe + 2H ="===" Fe2++ H2↑;B错,正确为:石灰石为难溶于水的物质,不能拆成离子形式;C错,除了生成硫酸钡外还有水生成;D正确;
="===" Fe2++ H2↑;B错,正确为:石灰石为难溶于水的物质,不能拆成离子形式;C错,除了生成硫酸钡外还有水生成;D正确;
本题难度:一般
2、选择题 下列化学反应的离子方程式正确的是?(?)
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)]4-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
参考答案:A
本题解析:A正确;B错,碳酸镁为微溶于水的固体,不能拆成离子形式;C错,其正确离子方程式为:Al3++3OH-=Al(OH)3↓;D错,正确离子方程式为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O
本题难度:一般
3、选择题 化学中常借助曲线图来表示某种变化过程,有人分别画出了下列的四个曲线图:
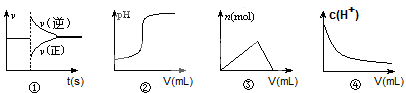
有关上述曲线图的说法正确的是:
A.曲线图①可以表示恒压容器中某化学平衡体系充入气体生成物后反应速率随时间的变化
B.曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的盐酸时的pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示冰醋酸加水稀释过程中溶液中c(H+)的变化
参考答案:A
本题解析:A、恒压条件下,充入气体生成物,生成物浓度增大,反应物浓度减小,平衡左移,故A正确;B、向一定量的氢氧化钠溶液中滴加一定浓度的盐酸时pH应该减小,错误;C、向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时,先产生沉淀,后沉淀会溶解一部分,但不会完全消失,错误;D、冰醋酸加水稀释过程中溶液中c(H+)先增大后减小,错误。
本题难度:一般
4、填空题 无机化合物可根据其组成和性质进行分类:
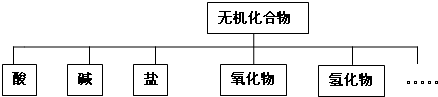
(1)上述所示的物质分类方法名称是______.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物
化学式
①HCl
②______
③______
④Ba(OH)2
⑤Na2CO3
⑥______
⑦CO2
⑧Na2O
⑨NH3
?⑩H2O
|
(3)下列10种物质:①水?②空气?③铜丝?④二氧化碳?⑤硫酸?⑥氢氧化钙
⑦盐酸?⑧Fe(OH)3胶体?⑨碳酸氢钙[Ca(HCO3)2]⑩NH3
属于电解质的是______;?属于非电解质的是______(填序号)
(4)按要求写出下列反应的离子方程式:
①锌跟稀硫酸反应______
②氢氧化钡溶液和稀硫酸反应______
③MgO滴加稀盐酸______.
参考答案:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,图示方法就是树状图,故答案为:树状分类法;
(2)以Na、K、H、O、S、N六五种元素中任意两种或三种元素可组成酸有:H2SO4、HNO3,碱有:NaOH、KOH、NH3?H2O,盐有:NaNO3、KNO3、Na2SO4、K2SO4、NH4NO3等,
故答案为:②H2SO4或HNO3?③NaOH或KOH,⑥NaNO3或KNO3或K2SO4或Na2SO4;
(3)属于电解质的是①、⑤、⑥、⑨;?属于非电解质的是④、⑩;故答案为:①、⑤、⑥、⑨;④、⑩;
(4)①锌跟稀硫酸反应的离子方程式:Zn+2H+═Zn2++H2↑;
②氢氧化钡溶液和稀硫酸反应的离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
③MgO滴加稀盐酸的离子方程式:MgO+2H+═Mg2++H2O;
故答案为:①Zn+2H+═Zn2++H2↑②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O③MgO+2H+═Mg2++H2O.
本题解析:
本题难度:简单
5、填空题 2g Cu2S和CuS的混合物在酸性溶液中用400mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
?MnO4-+?Fe2++?H+=?Mn2++?Fe3++H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为?g。
(4)混合物中Cu2S的质量分数为?。
参考答案:(1)1、5、8、1、5、4
(2)0.007
(3)19.6
(4)40%
本题解析:(2)设消耗高锰酸钾xmol,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
xmol 0.350L×0.1mol/L
所以x=0.007。剩余KMnO4的物质的量为0.007mol。
(3)设(NH4)2Fe(SO4)2?6H2O 的物质的量为ymol,
(NH4)2Fe(SO4)2?6H2O---- Fe2+
1mol?1mol
ymol ?0.500L×0.1mol/L
y=0.05,
所以其质量为m=nM=0.05mol×392g/mol=19.6g;
故答案为:19.6g。
(4)设Cu2S的物质的量为mmol,CuS的物质的量为nmol,
8MnO4-+44H++5Cu2S=10Cu2++5SO2+8Mn2++22H2O
8 ?5
8m/5mol ?mmol
6MnO4-+28H++5CuS=5Cu2++5SO2+6Mn2++14H2O
6 ?5
6n/5mol? nmol
所以列方程组为:160mg+96ng=2g,8m/5mo+6n/5mol,解得m=0.005,n=0.0125。
所以Cu2S的质量为0.8g,CuS的质量为1.2g,
Cu2S的质量分数为0.8g÷2g×100%=40%,
故答案为:40%
点评:本题考查了离子方程式的有关计算,难度较大,易错题是(2),注意铵根离子和(NH4)2Fe(SO4)2的关系式,根据铵根离子计算(NH4)2Fe(SO4)2的质量。
本题难度:一般